��Ŀ����
����Ŀ��ijǿ������ҺX������Fe3+��Fe2+��Ba2+��Al3+��NH4+��CO32����SiO32����SO42����NO3���е�һ�ֻ������ӣ�ȡ��Һ��������ʵ�飬��ʵ������ת����
����������Ϣ���ش��������⣺
��1��д���������������A�����ӷ���ʽ ��
��2������F�ĵ���ʽΪ �� ʵ���У����Թ۲쵽��Ӧ�ڵ������ǣ� ��
��3��������ҺI�д��ڵ������ӵķ����� ��
��4������G�Ļ�ѧʽΪ��д����Ӧ�ߵĻ�ѧ����ʽ ��
��5����ҺX�п϶������ڵ����������Բ���ȷ���Ƿ���ڵ����ӣ�������ȡX��Һ���Թ��У�ѡ�������Լ��е�һ�ּ���X��Һ�У���������Ϳ��жϣ�����Լ��� �� ��ѡ����ţ���pH��ֽ���ڷ�̪�Լ�����ʯ���Լ�����KSCN��Һ����NaOH��Һ����KMnO4��Һ��
���𰸡�
��1��3Fe2++NO3��+4H+=3Fe3++NO��+2H2O
��2��![]() ����������ɫ�����ɫ
����������ɫ�����ɫ
��3��ȡ������Һ���Թ��У�����Ũ����������Һ����ȣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ���ֽ������֤������NH4+
��4��Fe��OH��3��NaAlO2+CO2+2H2O=Al��OH��3��+NaHCO3
��5��Ba2+��CO32����SiO32����NO3������
���������⣺��ǿ������Һ��һ���������CO32����SiO32�����ӣ�����������ᱵ���ɳ�������ó���CΪBaSO4������˵����Һ�к���SO42�����ӣ���������A��A������������D��E����AΪNO��DΪNO2 �� EΪHNO3 �� ˵����Һ�к��л�ԭ�����ӣ�һ��ΪFe2+���ӣ�ǿ������Һ�о�һ������NO3�����ӣ���ҺB�м������NaOH��Һ����������F����FΪNH3 �� ˵����Һ�к���NH4+���ӣ������ᷴӦ����IΪNH4NO3 �� ����GΪFe��OH��3 �� ������������JΪFeCl3 �� ��ҺH��ͨ�����CO2���壬���ɳ���K����KΪAl��OH��3 �� LΪNaAlO2 �� ˵����Һ�к���Al3+���ӣ�����ȷ���Ƿ��е�����Fe3+ �� ���������軯����Һ.
��1.�����������Ӿ��л�ԭ�ԣ�������������ԣ����������ӱ����������������������ӣ����ᱻ��ԭ��һ������������ʽΪ3Fe2++NO3��+4H+=3Fe3++NO��+2H2O�����Դ��ǣ�3Fe2++NO3��+4H+=3Fe3++NO��+2H2O��
��2.����ҺB�м������NaOH��Һ����������F��NH4++OH��=NH3��+H2O�������ĵ���ʽ�� ![]() ��ʵ���У����Թ۲쵽��Ӧ�ڵ���������ɫһ��������Ϊ����ɫ�����������壬���Դ��ǣ�
��ʵ���У����Թ۲쵽��Ӧ�ڵ���������ɫһ��������Ϊ����ɫ�����������壬���Դ��ǣ� ![]() ����������ɫ�����ɫ��
����������ɫ�����ɫ��
��3.��IΪNH4NO3 �� ����笠����ӣ���ȡ������Һ���Թ��У�����Ũ����������Һ����ȣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ���ֽ������֤������NH4+ �� ���Դ��ǣ�ȡ������Һ���Թ��У�����Ũ����������Һ����ȣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ���ֽ������֤������NH4+��
��4.������GΪFe��OH��3 �� NaAlO2��Һ��ͨ�����������̼����ƫ�����ƺ�̼�����ƣ���Ӧ�����ӷ���ʽΪ��NaAlO2+CO2+2H2O=Al��OH��3��+NaHCO3 �� ���Դ��ǣ�Fe��OH��3��NaAlO2+CO2+2H2O=Al��OH��3��+NaHCO3��
��5.�������Ϸ�����֪һ���������Ba2+��CO32����SiO32����NO3��������SO42����Al3+��Fe2+��NH4+ �� ����ȷ���Ƿ��е�����Fe3+ �� ���������軯����Һ��ȡ����X��Һ�����Թ��У����뼸��KSCN����Һ���ɫ˵����Fe3+ �� ��֮�� Fe3+�����Դ��ǣ�Ba2+��CO32����SiO32����NO3�����ܣ�

����Ŀ��ij��ѧ��ȤС�����Ժ���������������������������ͭ��Һ�����ۺ�ʵ�飺
��1����ȥFe2+��Fe3+���Ʊ�CuSO45H2O��������������̻ش����⣺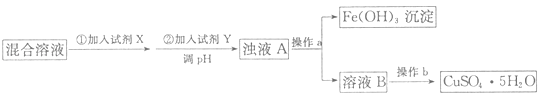
�й��������↑ʼ�����ͳ�����ȫ��pH���±���
�������� | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 |
��ʼ������pH | 1.9 | 6.5 | 4.7 |
������ȫ��pH | 3.7 | 9.7 | 6.7 |
���Լ�X�Ļ�ѧʽΪ �� �����Լ�Y������ҺpH�ķ�Χ����
�ڲ���a�õ��IJ�������Ϊ�ձ�����������������b������Ϊ��
��2����֪��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O�����ⶨ�����Һ�е�Fe2+��Ũ�ȣ�ȡ����Һ20.00mL����Ũ��Ϊ0.01molL��1������KMnO4��Һ�ζ������еζ���ʽ�У����������������ĸ��ţ��гֲ�������ȥ��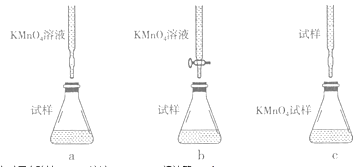
�ﵽ�յ�ʱ��ȥ����KMnO4��Һ12.00mL�������c��Fe2+��= ��
����Ŀ��ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�
�ٽ���ʽ�ζ���������ˮϴ�����ô�����Һ��ϴ����ע�������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶���������ƿ������ˮϴ�����ô�����Һ��ϴ��ƿ2��3�Σ��Ӽ�ʽ�ζ����з���25.00mL������Һ����ƿ�У�
�ڽ���ʽ�ζ���������ˮϴ�����ñ���Һ��ϴ��������ע��0.1000mol/L�����ᣬ���ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶�����
������ƿ�е����̪��ָʾ�������еζ����ζ���ָʾ���պñ�ɫ���Ҳ������ϱ�ɫΪֹ�����������������ΪV1mL��
���ظ����Ϲ��̣����ڵζ�����������ƿ����5mL������ˮ�����������������ΪV2mL���Իش��������⣺
��1����ƿ�е���Һʱ���ﵽ�ζ��յ㣮
��2����С���ڲ�����еĴ�����
�ɴ���ɵIJⶨ�����ƫ�ߡ�ƫ�ͻ���Ӱ�죩
��3����ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����ΪMl 
��4��������±����ݼ�������ռ���Һ��Ũ��mol/L��
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 25.00 | 0.50 | 20.40 |
�ڶ��� | 25.00 | 4.00 | 24.10 |

