题目内容
19.下列与实验相关的叙述正确的是( )| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若容量瓶没有干燥,还有少量蒸馏水,则配制后的溶液浓度偏低 | |
| C. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入稀盐酸和BaCl2溶液 |
分析 A.稀释浓硫酸,应防止酸液飞溅;
B.容量瓶中有少量的蒸馏水,对溶质的物质的量及最终溶液的体积没有影响;
C.向饱和FeCl3溶液中滴加过量氨水生成的是氢氧化铁沉淀;
D.氯化银和硫酸钡均是不溶于酸的白色沉淀,碳酸根可以和强酸反应.
解答 解:A.稀释浓硫酸,应将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒搅拌,防止酸液飞溅,故A错误;
B.容量瓶中有少量的蒸馏水,对溶质的物质的量及最终溶液的体积没有影响,所以不影响配制结果,故B错误;
C.向饱和FeCl3溶液中滴加过量氨水生成的是氢氧化铁沉淀,向沸水中滴加饱和氯化铁溶液加热至红褐色液体为氢氧化铁胶体,故C错误;
D.向试液中滴加适量稀盐酸无现象,然后再滴加BaCl2溶液,如果出现不溶于酸的白色沉淀,则未知溶液中含有SO42-,故D正确.
故选D.
点评 本题考查较为综合,涉及溶液的稀释以及溶液的配制、胶体的制备、离子的检验等,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
10.下列说法中,正确的是( )
| A. | 研究有机物一般要经过的基本步骤是:确定实验式→确定分子式→确定结构式→分离、提纯 | |
| B. | 石油的分馏、裂化、裂解和煤的干馏、液化、气化都是物理变化 | |
| C. | “三大合成材料”一般是指塑料、合成纤维、合成橡胶 | |
| D. | 糖类、油脂、蛋白质并不都是高分子化合物,但都可以在一定条件下发生水解反应 |
7.碳酸铜和碱式碳酸铜〔Cu2(OH)2CO3〕均可溶于盐酸,转化为氯化铜.在高温下这两种化合物均能分解生成氧化铜.溶解28.4g的上述混合物,消耗2mol•L-1的盐酸250mL.灼烧等量的上述混合物,得到氧化铜的质量是( )
| A. | 40 g | B. | 30 g | C. | 20 g | D. | 15 g |
14. 已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
 已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T2>T1 P1>P2 m+n>P△H<0 | B. | T1>T2 P1<P2 m+n<P△H>0 | ||
| C. | T1<T2 P1<P2 m+n<P△H<0 | D. | T1>T2 P1<P2 m+n>P△H>0 |
11.下列石油制品中,沸点范围最低的是( )
| A. | 柴油 | B. | 润滑油 | C. | 汽油 | D. | 煤油 |
8.向氯酸钠的酸性水溶液中通入二氧化硫,反应中氧化过程为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X可能是( )
| A. | ClO2 | B. | NaClO4 | C. | HClO | D. | NaClO |
9.下列各离子组的叙述正确的是( )
| A. | 在强酸性条件下Na+、IO-、K+、可以大量共存 | |
| B. | 在强碱性条件下K+、AlO2-、Na+、NO3-可以大量共存 | |
| C. | 在水溶液中H+、NH4+、SiO32-、Cl-不能大量共存 | |
| D. | 在强酸性条件下NH4+、K+、SO32-、S2-可以大量共存 |
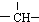 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.