题目内容
18.(1)在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图1.下列说法正确的是ac(填序号字母)a.0~t1时,v正>v逆,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ

(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(l)+H2O(g)△H<0t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④图2所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
(3)CH4燃料电池,装置示意如图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当 0<V≤44.8L时,电池总反应方程式为CH4+2O2+KOH=KHCO3+2H2O.
分析 (1)a、由图象分析可知,0~t1,反应正向进行,v正>v逆,t1~t2,反应到达平衡,v正=v逆,t2时,反应逆向进行;
b、根据气体的密度等于气体质量和体系体积的比值来判断;
c、向密闭容器中加C,逆反应速率瞬间增大,再次建立的平衡与原平衡等效,说明和原平衡相同;
d、由图象分析可知,t2时刻改变条件后达到平衡逆反应速率不变,说明和原平衡等效,则平衡常数不变.
(2)①根据反应速率v=$\frac{△c}{△t}$来计算化学反应速率;
②当向容器中再加入气体,相当于增大压强,会向着气体系数和减小的方向进行;
③根据三行式计算化学反应的平衡常数;
④电解尿素〔CO(NH2)2〕的碱性溶液,在阳极上发生失电子的氧化反应,据此书写电极反应式;
(3)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应,实验分离出的溶液是氯化铝溶液,惰性电极电解阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,附近氢氧根离子和铝离子反应生成氢氧化铝沉淀,随氢氧根离子浓度增大,氢氧化铝可以溶解于碱中,由此分析解答.
解答 解:(1)a、0~t1,反应正向进行,v正>v逆,t1~t2,反应到达平衡,v正=v逆,t2时,反应逆向进行,v逆>v正,故a正确;
B、混合气体的密度等于气体质量和体系体积的比值,反应中质量守恒,前后气体系数和相等,所以当密度不再改变时,不一定平衡,故b错误;
C、向密闭容器中加C,逆反应速率瞬间增大,再次建立的平衡与原平衡等效,说明和原平衡相同,符合图象,故c正确;
D、t2时刻改变条件后达到平衡逆反应速率不变,说明和原平衡等效,所以Ⅰ、Ⅱ两过程达到平衡时,平衡常数I=Ⅱ,故d错误;
故选:ac;
(2)①70min时,平均反应速率υ (CO2 )=$\frac{\frac{0.1mol-0.02mol}{2L}}{70min}$mol/(L•min)=0.00057mol/(L•min)=5.7×10-4mol/(L•min);故答案为:5.7×10-4mol/(L•min);
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后相当于增大压强,会向着气体系数和减小的方向进行,即向着正方向进行,所以CO2的转化率与原平衡相比将增大,故答案为:增大;
③可逆反应在70min时达到了平衡,
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(l)+H2O(g)
初始浓度:0.05 0.2 0
变化浓度:0.04 0.08 0.04
平衡浓度:0.01 0.12 0.04
所以K=$\frac{c({H}_{2}O)}{c(C{O}_{2})•{c}^{2}(N{H}_{3})}$=$\frac{0.04}{0.01×0.1{2}^{2}}$≈277.8,故答案为:277.8;
④电解尿素〔CO(NH2)2〕的碱性溶液,在阳极上发生失电子的氧化反应,电极反应式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(3)n(KOH)=2mol/L×1L=2mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,发生反应①②③,电池总反应式为CH4+2O2+KOH=KHCO3+2H2O,实验分离出的溶液是碳酸氢钾溶液,惰性电极电解阳极氢氧根离子放电生成氧气,阴极氢离子放电生成氢气,故答案为:CH4+2O2+KOH=KHCO3+2H2O.
点评 本题考查了通过计算书写燃料电池的电极反应式、化学反应速率和平衡的有关计算等重要考点,涉及的知识点较多,综合性较强,难度较大.

 特高级教师点拨系列答案
特高级教师点拨系列答案 A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:| A | 宇宙中含量最丰富的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最高价氧化物对应的水化物与其氢化物反应生成盐 |
| D | 原子核外电子有8种不同的运动状态 |
| E | 基态原子核外有六个未成对电子 |
| F | 原子最外层只有一个电子 |
(1)基态E原子的核外M层电子云有9种不同的伸展方向,基态E原子核外价电子排布式为3d54s1,元素F属于d区.
(2)A与C形成的最简单分子的空间构型为三角锥形,中心原子的杂化方式为sp3.
(3)B,C,D第一电离能由大到小的顺序是N>O>C(用元素符号表示);由B,C,D中的两种元素组成的常见分子互为等电子体的是N2O和CO2
(4)E元素可以形成配位 数为6的两种配合物,它们的化学式都是ECl3﹒6H2O,其中一种呈亮棕色,与硝酸银溶液反应时,能沉淀出$\frac{1}{3}$的氯元素,该配合物可表示为[Cr(H2O)4Cl2]Cl•2H2O.
(5)元素F的一种氯化物的晶胞结构如图 所示(黑球表示F原子,白球表示氯原子),每个氯原子周围与之距离最近的氯原子个数为12;若晶胞的密度为4.14g﹒cm-3,该晶胞的边长为$\root{3}{\frac{398}{4.14{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
| A. | 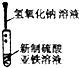 制备氢氧化亚铁 | B. | 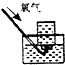 收集氧气 | ||
| C. |  制备并检验氢气的可燃性 | D. | 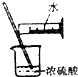 浓硫酸稀释 |
| A. | 锌粒投入Cu(NO3)2溶液中,反应后固体物质增重 | |
| B. | 22.4L Cl2通入足量NaOH溶液,反应时转移的电子数为2NA | |
| C. | lmol Na在空气中加热燃烧,反应时转移的电子数为NA | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
| A. | 原子半径:D>C>B>A | |
| B. | 气态氢化物的热稳定性:HmB>HnC | |
| C. | 由A、B、C三种元素形成的化合物均只含有共价键,不含离子键 | |
| D. | 单质D与水反应放出氢气,当转移2NA个电子时,产生氢气的体积为22.4升(标准状况) |
| A. | 原子半径A>B>C>D | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 单质的还原性A>B离子的还原性C2?>D? |
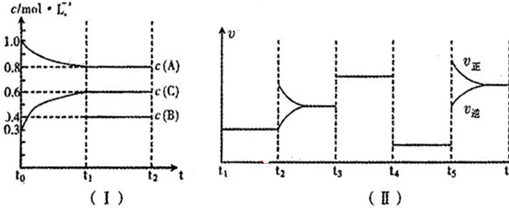
请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)
 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
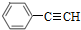 的合成方法有:
的合成方法有: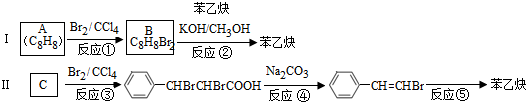

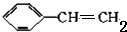 ,反应①,②涉及的反应类型是加成反应、消去反应.
,反应①,②涉及的反应类型是加成反应、消去反应.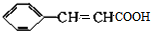 ,反应⑤的化学方程式为
,反应⑤的化学方程式为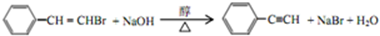 (注明反应条件)
(注明反应条件)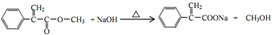 .
.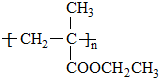 单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为
单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为 .
.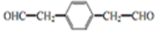 .
.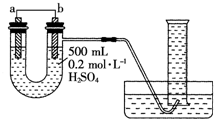 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题: