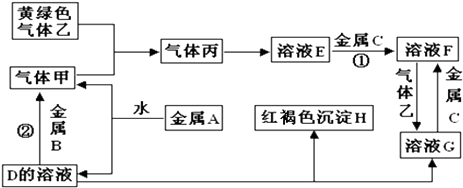
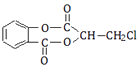
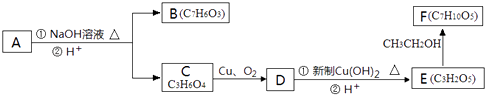
题目内容
【题目】用惰性电极电解CuSO4 和KNO3的混合溶液500mL,经过一段时间后,两极均得到标准状况下11.2L的气体,则原混合液中CuSO4的物质的量浓度为( )
A.0.5 molL﹣1
B.0.8 molL﹣1
C.1.0 molL﹣1
D.1.5 molL﹣1
【答案】C
【解析】解:用Pt电极电解1L含CuSO4和KNO3混合溶液,在两极均生成标准状况下的气体11.2L,气体的物质的量为n= ![]() =0.5mol,溶液中阳离子放电顺序Cu2+>H+ , 阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH﹣﹣4e﹣=2H2O+O2↑,生成0.5molO2 , 需电子为4×0.5mol=2mol;
=0.5mol,溶液中阳离子放电顺序Cu2+>H+ , 阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH﹣﹣4e﹣=2H2O+O2↑,生成0.5molO2 , 需电子为4×0.5mol=2mol;
阴极电极反应为:Cu2++2e﹣=Cu、2H++2e﹣=H2↑,生成0.5molH2 , 需0.5mol×2=1mol电子,依据电子守恒,铜离子得到电子1mol,反应的铜离子物质的量0.5mol,所以Cu2+的物质的量浓度C= ![]() =1mol/L,
=1mol/L,
故选C.

练习册系列答案
相关题目