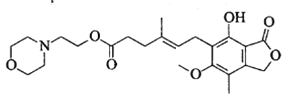
题目内容
【题目】电解NO制备NH4NO3的工作原理如图所示,X、Y均为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )

A.物质A为HNO3
B.X电极为阳极
C.利用该装置电解2molNO理论上可生成1.25molNH4NO3
D.Y电极反应式为NO-3e-+4OH-=NO3-+2H2O
【答案】C
【解析】
电解NO制备NH4NO3,Y为阳极反应为NO-3e-+2H2O=NO3-+4H+,X为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为: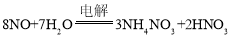 ,因此若要使电解产物全部转化为NH4NO3,需补充NH3,据此分析.
,因此若要使电解产物全部转化为NH4NO3,需补充NH3,据此分析.
A.根据以上分析,则A为NH3,故A错误;
B.根据以上分析,X电极为电解池阴极,故B错误;
C.补充NH3后总反应方程式变为: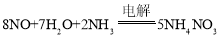 ,根据方程式可知电解8molNO理论上产生5mol NH4NO3,所以利用该装置电解2molNO理论上可生成1.25molNH4NO3,故C正确;
,根据方程式可知电解8molNO理论上产生5mol NH4NO3,所以利用该装置电解2molNO理论上可生成1.25molNH4NO3,故C正确;
D.Y为阳极反应为:NO-3e-+2H2O=NO3-+4H+,故D错误;
故选:C。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】碱式碳酸钴[ Cox(OH)y(CO3)z ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。

(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_____________________
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的______(填字母)连接在_________(填装置连接位置)。

(4)若按正确装置进行实验,测得如下数据:
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_________________。
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为___________。
(6)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:

已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为
③加盐酸调整PH为2~3的目的为__________________________________。
④操作Ⅱ过程为___________(填操作名称)、过滤。
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
【题目】H、Al、O、N、S、Fe是常见的六种元素。
(1)S位于元素周期表______周期第______族,Fe的基态原子核外价电子排布式为______;O的基态原子核外有______种运动状态不同的电子。
(2)用“>”“<”或“=”填空
第一电离能 | 氧化性 | 沸点 | 非金属性 |
N______S | Fe3+______ Al3+ | NH3______H2O | 16O______18O |
(3)已知:下列两个热化学方程式:
4Fe(s)+302(g)=2Fe2O3(s)△H=﹣a kJ/mol
4Al(s)+3O2(g)=2Al2O3(s)△H=﹣b kJ/mol
则Al(s)的单质和Fe2O3(s)反应的热化学方程式是______。
(4)FeSO4溶液可与硝酸发生反应,写出此反应的离子方程式,并标出电子转移的方向和数目____________________________。