题目内容
【题目】某酸性燃料电池酒精检测仪原理如图所示。下列说法中正确的是( )
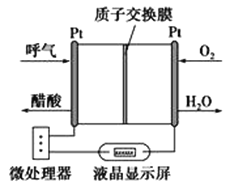
A.正极上发生的反应是:O2+4e-+2H2O===4OH-
B.负极上发生的反应是:CH3CH2OH-4e-+H2O ===CH3COOH+4H+
C.检测时,电解质溶液中的H+向负极移动
D.若有0.4 mol电子转移,则消耗标准状况下4.48 LO2
【答案】B
【解析】
酸性乙醇燃料电池的负极反应为![]() ,正极上
,正极上![]() 得电子发生还原反应,电极反应式
得电子发生还原反应,电极反应式![]() 可根据电极反应式判断离子和电子转移问题。
可根据电极反应式判断离子和电子转移问题。
A.正极上氧气得电子和氢离子反应生成水所以其电极反应式为![]() ,故A错误;
,故A错误;
B.负极发生氧化反应,负极上电极反应式为![]() ,故B正确;
,故B正确;
C.原电池放电时,氢离子向正极移动,故C错误;
D.若有0.4mol电子转移,根据![]() 知,消耗标况下氧气的体积V=2.24L,故D错误;
知,消耗标况下氧气的体积V=2.24L,故D错误;
故选B。

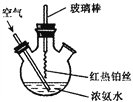
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间隙法”制取,反应原理、实验装置图(加热装置都已略去)如下:![]()
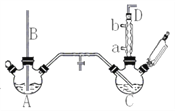
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是___________,冷凝管中冷水应从______(填“a”或“b”) 处通入。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是_________(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、________和________;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:_____________________;_________________;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是________________;
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
则lt苯可制得成品为________________t(只要求列式)。
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 20.02 | 20.00 |
2 | 0.1000 | _______ | 20.00 |
3 | 0.1000 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒、烧杯外,还需要的玻璃仪器有__________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是__________。判断滴定终点的现象是_____
(3)实验2,滴定前液面在“0”刻度处,滴定后液面如图所示,其读数为________mL。根据上述数据,可计算出该盐酸的浓度为__________。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有(_______)
A. 配制标准溶液定容时,仰视刻度线
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
【题目】在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)![]() X(g)+Y(g) △H;所得实验数据如表所示:
X(g)+Y(g) △H;所得实验数据如表所示:
实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推断正确的是( )
A.上述反应中,△H<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4min达到平衡,0~4 min内υ(X)=0.2mol·L-1·min-1
D.实验③中a=6.00