题目内容
某密闭容器中发生如下反应:2X(g)+Y(g)  Z(g);△H <0 下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H <0 下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是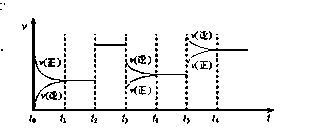
| A.t3时减小了压强 |
| B.t5时增大了压强 |
| C.t6时刻后反应物的转化率最高 |
| D.t1 - t2时该反应的平衡常数大于t6 时反应的平衡常数 |
BC
解析试题分析:A、减小压强,平衡向增大体积的方向移动,所以一开始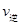 >
> ,随后又逐渐恢复到原来的反应速率,错误;B、增大压强,平衡向减少体积的方向移动,一开始
,随后又逐渐恢复到原来的反应速率,错误;B、增大压强,平衡向减少体积的方向移动,一开始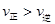 ,随后又逐渐恢复到原来的反应速率,正确;C、当不改变反应物用量,平衡向你反应方向移动,反应物的转化率降低,正确;D、根据平衡常数的公式,错误。
,随后又逐渐恢复到原来的反应速率,正确;C、当不改变反应物用量,平衡向你反应方向移动,反应物的转化率降低,正确;D、根据平衡常数的公式,错误。
考点:考查化学平衡的知识点。

对于化学反应方向的确定,下列说法正确的
| A.反应的焓变是决定反应能否自发进行的唯一因素 |
| B.温度、压强一定时,放热反应能自发进行 |
| C.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| D.固体的溶解过程与焓变无关 |
在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g)(正反应为放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g)(正反应为放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: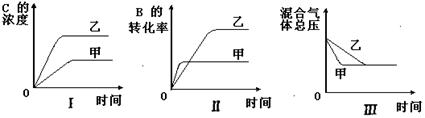
下列判断一定错误的是( )
| A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
下列事实不能用平衡移动原理解释的是
| A.工业合成氨时使用催化剂 |
| B.配制FeCl3溶液时加入少量的盐酸 |
| C.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L |
| D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是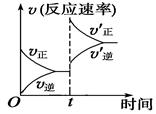
| A.加压 | B.升温 |
| C.增大水蒸气浓度 | D.增大碳的物质的量 |
某温度下,把3molA和2.5molB混合,盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气) xC(气)+2D(气)
xC(气)+2D(气)
经过5min后达到平衡生成1mol D , 测得C的平均生成速率为0.10mol·L-1·min-1。下列叙述不正确的是( )
| A.x的值为2 |
| B.B的转化率为20% |
| C.平衡常数为1/3 |
| D.A的平均消耗速率为0.15mol·L-1·min-1 |
可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )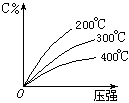
| A.达平衡后,加入催化剂则C%增大 |
| B.化学方程式中n>e+f |
| C.达平衡后,若升温,平衡右移 |
| D.达平衡后,增加A的量有利于平衡向右移动 |
在100 ℃时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是 ( )
| A.前2 s以N2O4的浓度变化表示的反应速率为0.01 mol·L-1·s-1 |
| B.在2 s时体系内的压强为开始时的1.1倍 |
| C.在平衡时体系内含N2O4 0.25 mol |
| D.平衡时,N2O4的转化率为40% |
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO3为0.4mol/L |
| C.SO2、S03均为0.15mol/L | D.SO2为0.25mol/L |