题目内容
将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个AlO2-,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为( )
A.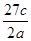 | B.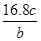 | C. | D. |
C
① ×3NA=d;NA=
×3NA=d;NA= ,C正确;②
,C正确;② ×2NA=d,NA=
×2NA=d,NA=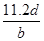 ,D错误;③
,D错误;③ NA=c,NA=
NA=c,NA= ,A错误;④
,A错误;④ ×
× NA=c,NA=
NA=c,NA= ,B错误。
,B错误。
 ×3NA=d;NA=
×3NA=d;NA= ,C正确;②
,C正确;② ×2NA=d,NA=
×2NA=d,NA=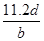 ,D错误;③
,D错误;③ NA=c,NA=
NA=c,NA= ,A错误;④
,A错误;④ ×
× NA=c,NA=
NA=c,NA= ,B错误。
,B错误。
练习册系列答案
相关题目

 aTiCl4+cCO……反应①
aTiCl4+cCO……反应① Ti+2MgCl2……反应②
Ti+2MgCl2……反应②
 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。