题目内容
20.(1)标准状况下有①0.112L水 ②0.5NA个HCl分子 ③25.6g SO2气体 ④0.2mol氨气 ⑤2mol氦气 ⑥6.02×1023个白磷(P4)分子,所含原子个数从大到小的顺序为①>⑥>⑤>③>②>④.(2)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为$\frac{8}{29}$.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为$\frac{14}{29}$.(都以分数表示)
(3)最近材料科学家研究发现了首例带结晶水的晶体在5K下呈现超导性.据报道,该晶体的化学式为Na0.35CoO2•1.3H2O(晶体的摩尔质量为122g•mol-1).若用NA表示阿伏加德罗常数,试计算12.2g该晶体中含氧原子数0.33NA,氢原子的物质的量0.26mol.
分析 (1)根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水的物质的量;根据n=$\frac{N}{{N}_{A}}$计算HCl、白磷物质的量;根据n=$\frac{m}{M}$计算SO2物质的量,结合每个分子含有的原子数目计算含有原子总物质的量,注意稀有气体为单原子分子;
(2)混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的物质的量为xmol、O2的物质的量为ymol,根据平均相对分子质量确定x、y关系,据此计算解答;
(3)根据n=$\frac{m}{M}$计算12.2g晶体的物质的量,结合化学式计算含有氧原子、H原子物质的量,再根据N=nNA计算氧原子数目.
解答 解:(1)①0.112L水的质量为112mL×1g/mol=112g,含有原子物质的量为$\frac{112g}{18g/mol}$×3=18.7mol,
②0.5NA个HCl分子含有原子为:$\frac{0.5{N}_{A}}{{N}_{A}mo{l}^{-1}}$×2=1mol;
③25.6g SO2气体含有原子物质的量为:$\frac{25.6g}{64g/mol}$×3=1.2mol;
④0.2mol氨气含有原子物质的量为:0.2mol×4=0.8mol;
⑤2mol氦气含有原子物质的量为:2mol×1=2mol;
⑥6.02×1023个白磷(P4)分子含有原子物质的量为:1mol×4=4mol;
故所含原子个数从大到小的顺序为:①>⑥>⑤>③>②>④,
故答案为:①>⑥>⑤>③>②>④;
(2)混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的总物质的量为xmol、O2的物质的量为ymol,则28x+32y=29(x+y),整理得x:y=3:1,故氧气的质量分数=$\frac{1mol×32g/mol}{1mol×32g/mol+3mol×28g/mol}$=$\frac{8}{29}$;
其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为$\frac{1mol×32g/mol+1.5mol×16g/mol}{1mol×32g/mol+3mol×28g/mol}$=$\frac{14}{29}$,
故答案为:$\frac{8}{29}$;$\frac{14}{29}$;
(3)12.2g晶体的物质的量为$\frac{12.2g}{122g/mol}$=0.1mol,结合化学式可知含有氧原子为0.1mol×3.3×NAmol-1=0.33NA,含有氢原子物质的量为0.1mol×2.6=0.26mol,
故答案为:0.33NA;0.26.
点评 本题考查阿伏伽德罗定律及物质的量有关计算,难度不大,旨在考查学生对基础知识的理解掌握.

 全能练考卷系列答案
全能练考卷系列答案| A. | 0.5mol/L盐酸 | B. | 自来水 | ||
| C. | 0.5mol/L硫酸 | D. | 0.5mol/L 氢氧化钡 |
| A. | 把烧杯放在垫有石棉网的铁圈上加热 | |
| B. | 为了不造成浪费,实验剩余的药品放回原瓶 | |
| C. | 用100ml量筒量取8.5ml的水 | |
| D. | 用燃着的酒精灯去点燃另一酒精灯 |
| A. | HCHO | B. | CH3OH | C. | HOOCCOOH | D. | 纤维素(C6H10O5)n |
(2)如表给出部分物质在不同温度下的溶解度:
| 温 度 | 0℃ | 10℃ | 20℃ | 30℃ |
| NaCl | 35.7g | 35.8g | 36.0g | 36.3g |
| NaHCO3 | 6.9g | 8.2g | 9.6g | 11.1g |
| Na2CO3•10H2O | 7.0g | 12.5g | 21.5g | 38.8g |
| A. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- | |
| B. | Cl2通入NaOH溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:H++Mg2++3OH-=Mg(OH)2↓+H2O | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
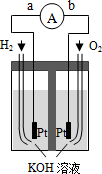 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: 直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.