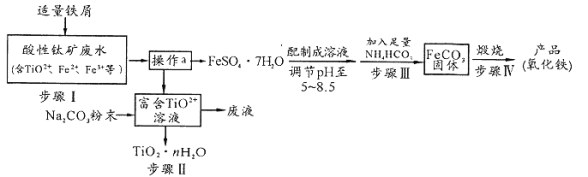
题目内容
【题目】现有如下两个反应:(A)NaOH+HCl===NaCl+H2O (B)2FeCl3+Cu===2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A)______,(B)________;
(2)如果(A或B)不能,说明其原因_________________________________________;
(3)如果(A或B)可以,则在下面方框中画出装置图并写出正、负极材料及电极反应式
________
负极:________、_______________________________________;
正极:________、________________________________________。
【答案】 不能 能 (A)不是氧化还原反应,没有发生电子的转移  铜片 Cu-2e-=Cu2+ 碳棒 2Fe3++2e-=2Fe2+
铜片 Cu-2e-=Cu2+ 碳棒 2Fe3++2e-=2Fe2+
【解析】(1)A中没有元素的化合价变化,不发生氧化还原反应;B中Cu、Fe元素的化合价变化,为氧化还原反应,且放热,则B能设计成原电池,故答案为:不能;能;
(2)A不能设计成原电池,因为A中没有元素的化合价变化,不发生氧化还原反应,故答案为:A;不是氧化还原反应,没有发生电子的转移;
(3)Cu+2Ag+=2Ag+Cu2+中,Cu失去电子,Cu为负极,失去电子被氧化,发生氧化反应,选择电解质为硝酸银,正极上银离子得到电子生成Ag,现象为银白色金属析出,装置图为 ,电极方程式分别为:负极为铜片:Cu-2e-=Cu2+;正极为碳棒:2Fe3++2e-=2Fe2+,故答案为:
,电极方程式分别为:负极为铜片:Cu-2e-=Cu2+;正极为碳棒:2Fe3++2e-=2Fe2+,故答案为: ;铜片;Cu-2e-=Cu2+;碳棒;2Fe3++2e-=2Fe2+。
;铜片;Cu-2e-=Cu2+;碳棒;2Fe3++2e-=2Fe2+。

练习册系列答案
相关题目