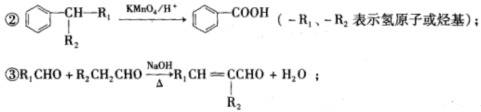
题目内容
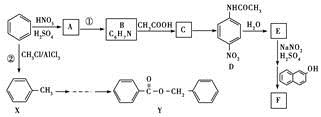
某芳香烃X是一种重要的有机化工原料,质谱法测定其相对分子质量为92.现以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去),其中A是一氯代物,F的分子式为C7H7NO2,Y是一种功能高分子材料。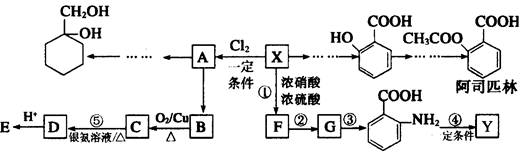
已知:
请根据所学知识与本题所给信息回答下列问题:
(1)X的化学式是_____________,其核磁共振氢谱图有____________个吸收峰;
(2)反应⑤的化学方程式是______________________________;
(3)阿司匹林分子中含有的官能团的名称是______________;1mol阿司匹林与足量NaOH溶液反应最多消耗NaOH的物质的量为_____________________。
(4)Y的结构简式为___________________________________。
(5) 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 _________种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 _________种;
(6)以下是由A和其它物质合成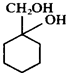 的流程图,
的流程图,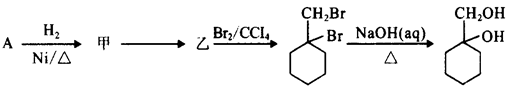
甲→乙反应的化学方程式为_______________________________________________。
(1)C7H8(2分) 4(1分)
(2) +2Ag(NH3)2OH
+2Ag(NH3)2OH
 +2Ag↓+3NH3+H2O(2分)
+2Ag↓+3NH3+H2O(2分)
(3)酯基、羧基(2分) 3mol(2分)
(4)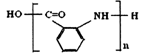 (2分) (5)6(2分)
(2分) (5)6(2分)
(6)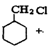 NaOH
NaOH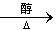
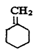 +NaCl+H2O(2分)
+NaCl+H2O(2分)
解析试题分析:
某芳香烃X相对分子质量为92,可推断出分子式为C7H8。满足通式CnH2n-6,所以可推断出应为甲苯。
与Cl2发生取代反应得到一氯代物A,根据A→B→C→D,由 C发生银镜反应得到D, C属于醛类,B应
属于醇类。所以可以得出甲苯与Cl2发生一氯取代应是在甲基上而不是在苯环上。所以A到B应是卤代烃
的水解得到苯甲醇B,再氧化得到苯甲醛C,再发生银镜反应得到苯甲酸铵D,后酸化得到苯甲酸E。
由X:C7H8经过硝化反应得到F:C7H7NO2,可以在甲基的邻对位取代(硝基取代H原子),
由X→F→G→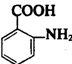 ,可推知引入了氨基,根据题目所给信息,原氨基位置应是硝基。所以从X到F
,可推知引入了氨基,根据题目所给信息,原氨基位置应是硝基。所以从X到F
硝化过程中,硝基取代了甲基邻位上的一个氢原子。在这个过程中同时引入了—COOH,所以存在一个先
后顺序,是先引入—NH2还是先引入—COOH,—COOH引入是由酸性KMnO4氧化得到。氨基是由硝基还
原得到。是先氧化还是先还原?应是现将甲基氧化为—COOH后再将—NO2还原得到—NH2。而不能先将
—NO2还原得到—NH2后,再将甲基氧化为—COOH,因为这个过程中,不仅甲基被氧化,同时氨基也被
氧化。
(1)X的化学式是C7H8,甲苯中存在4种氢原子,苯环上3种,甲基上1种。其核磁共振氢谱图有4个吸收峰;
(2)反应⑤的化学方程式 +2Ag(NH3)2OH
+2Ag(NH3)2OH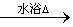
 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O;
(3)阿司匹林分子中含有的官能团的名称是酯基、羧基;1mol阿司匹林与足量NaOH溶液反应最多消耗NaOH的物质的量为3mol,其中酚酯2mol,羧基1mol。
(4)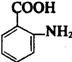 到Y,Y属于高分子化合物,所以应该发生缩聚反应。形成高分子化合物两种途径,一种是加聚反应,另一种是缩聚反应。在这里应该为缩聚(羧基与氨基)。所以Y应该为
到Y,Y属于高分子化合物,所以应该发生缩聚反应。形成高分子化合物两种途径,一种是加聚反应,另一种是缩聚反应。在这里应该为缩聚(羧基与氨基)。所以Y应该为 。
。
(5)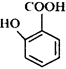 有多种同分异构体,其中含有1个醛基和2个羟基,相当于把一个羧基拆成一个羟基和一个醛基。先画两个羟基的情况有3种,2个羟基在邻位,放醛基进去,这样的结构有2种。2个羟基在间位,放1个醛基,这样的结构有3种。2个羟基在对位,放1个醛基进去,这样的结构有一种。共6种。
有多种同分异构体,其中含有1个醛基和2个羟基,相当于把一个羧基拆成一个羟基和一个醛基。先画两个羟基的情况有3种,2个羟基在邻位,放醛基进去,这样的结构有2种。2个羟基在间位,放1个醛基,这样的结构有3种。2个羟基在对位,放1个醛基进去,这样的结构有一种。共6种。
(6)以下是由A和其它物质合成 的流程图,
的流程图,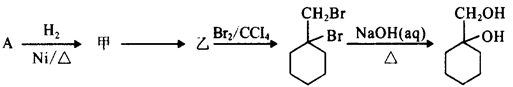
甲苯上甲基一取代后得到A,再与H2加成得到甲: 再消去反应得到乙:
再消去反应得到乙: 。再与Br2加成得到
。再与Br2加成得到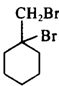 ,在NaOH水溶液中发生水解反应得到
,在NaOH水溶液中发生水解反应得到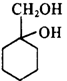 。
。
所以甲→乙反应的化学方程式为:

 +NaCl+H2O。
+NaCl+H2O。
考点:本题是一道有机工艺流程题。所考查知识点较多:化学式的求算,核磁共振氢谱图吸收峰个数的判断,官能团的性质与转化,消耗NaOH量的计算,缩聚反应,有限制条件同分异构体的书写以及官能团的保护等;

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案(15分)乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。在实验室制备乙酰苯胺常用苯胺与乙酸反应,反应方程式为:
实验的具体操作步骤流程图:
相关的文献数据如下:
| 试剂名称 | 相对分子质量 | 密度g/ml | 熔点℃ | 沸点℃ | 溶解度 |
| 苯胺 | 93 | 1.02 | -6.2 | 184.4 | 稍溶于水,与乙醇、乙醚、苯混溶 |
| 乙酸 | 60 | 1.05 | 16.7 | 118 | 溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 1.21 | 114~116 | 280~290 | |
(1)实验时将苯胺、乙酸和锌粉放在单口圆底烧瓶中进行混合加热,所选单口圆底烧瓶的最佳规格是
A. 50mL B. 100mL C. 150mL D. 200mL
(2)量筒所接的蒸馏物是__________(填化学式)。实验这样设计的目的是__________。
(3)通过重结晶提纯产物,则乙酰苯胺在水中溶解性的变化特征是_________________。
(4)对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________。
(5)锌粉几乎不与纯净的乙酸反应,但随着上述制备乙酰苯胺的反应而会消耗乙酸,原因是_____。
(6)实验所得无色片状晶体干燥后称量目标产物质量为4.0g,请计算所得到乙酰苯胺的产率是___。
下列贮存药品的方法中,正确的是
| A.浓硫酸保存在橡胶塞塑料试剂瓶中 | B.水玻璃保存在磨口玻璃塞的试剂瓶中 |
| C.浓硝酸保存在玻璃塞的棕色试剂瓶中 | D.纯碱溶液保存在磨口玻璃塞试剂瓶中 |
下列有关实验的说法正确的是
| A.在中和热测定的实验中,将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度 |
| B.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,先用稀硫酸进行酸化,再加入AgNO3溶液进行检验 |
| C.为了加快过滤速度以及得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
| D.用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 |
下列结论均出自《实验化学》中的实验,其中正确的是 ( )
| A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4能从中萃取出碘 |
| B.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只要将溶液蒸干即可 |
| C.用移液管取液后,将移液管稍倾斜放入垂直的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| D.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
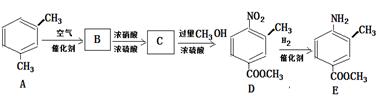


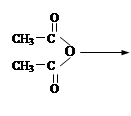 R—NHCOCH3 + CH3COOH (R为烃基)
R—NHCOCH3 + CH3COOH (R为烃基) (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子。
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子。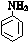 →B的反应类型是 。
→B的反应类型是 。