题目内容
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
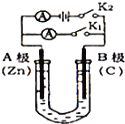
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 .若所盛溶液为KCl溶液:则B极的电极反应式为 .
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);B电极上的电极反应式为 ,总反应化学方程式是 .
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”).
【答案】(1)负;Zn﹣2e﹣=Zn2+;O2+2H2O+4e﹣=4OH﹣;
(2)有无色气体产生,电极附近溶液变红;A;2Cl﹣﹣2e﹣=Cl2↑;
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)纯铜;Cu2++2e﹣=Cu;减小。
2NaOH+H2↑+Cl2↑;(3)纯铜;Cu2++2e﹣=Cu;减小。
【解析】
试题分析:(1)打开K2,闭合K1,此装置是原电池的装置,根据构成原电池的条件,活泼金属作负极,即A极为负极,B极为正极,负极上失去电子,化合价升高,因此负极反应式为Zn-2e-=Zn2+,如果电解质为KCl,此反应锌的吸氧腐蚀,B极反应式为O2+2H2O+4e-=4OH-;(2)打开K1,闭合K2,此装置为电解池装置,A连接电源的负极,因此A为阴极,发生反应式为:2H2O-2e-=H2↑+OH-,出现的现象是有无色气体产生,且溶液变红;根据电解原理,阳离子向阴极移动,阴离子向阳极移动,即Na+向A极移动;B连接电源的正极,B极作阳极,因此反应式为2Cl--2e-=Cl2↑,两式相加得到:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)精炼铜时,粗铜作阳极,纯铜作阴极,电解质溶液是含Cu2+,因此A极为纯铜,电极反应式为Cu2++2e-=Cu,粗铜中含有锌、铁等杂质,锌和铁先失电子,因此Cu2+的浓度减小。
2NaOH+H2↑+Cl2↑;(3)精炼铜时,粗铜作阳极,纯铜作阴极,电解质溶液是含Cu2+,因此A极为纯铜,电极反应式为Cu2++2e-=Cu,粗铜中含有锌、铁等杂质,锌和铁先失电子,因此Cu2+的浓度减小。

【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是____________________。再由a向c中加2 mL蒸馏水,c中的实验现象是 ___________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________。理由是_____________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |

