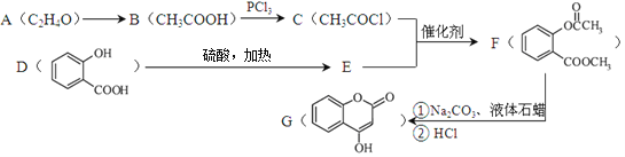
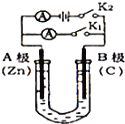
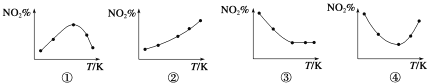
题目内容
【题目】氧化钙在2973 K时熔化,而NaCl在1074 K时熔化,二者的离子间距和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是
A.氧化钙晶体中阴、阳离子所带电荷数多
B.氧化钙晶格能比氯化钠的晶格能大
C.两种晶体的晶胞结构类型不同
D.氧化钙、氯化钠的离子间距类似情况下,晶格能主要由阴、阳离子所带电荷数决定
【答案】C
【解析】
试题分析:CaO和NaCl都属于离子晶体,熔点的高低可根据晶格能的大小判断。晶格能的大小与离子所带电荷数多少、离子间距离、晶体结构类型等因素有关。CaO和NaCl的离子间距离和晶体结构都类似,答案选C。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
【题目】仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 | … |
A. C6H14 B. C6H12 C. C7H12 D. C7H14