题目内容
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.
含有农药、染料、酚、氰化物,具有臭味的废水,常用氧化法进行处理.一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-离子)的废水.在碱性条件下(PH=8.5~11),氯气可将氰化物中CN-氧化为比它毒性小1000倍的氰酸盐(含CNO-).
(1)写出含CN-废水中用氯气氧化,生成氰酸盐时的离子方程式 .
(2)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,写出反应的离子方程式 .
(3)ClO2也可将剧毒氰化物氧化成无毒气体而除去,写出用ClO2氧化除去CN-的离子方程式 .ClO2消毒(氧化)效率是同质量消毒剂NaClO的 倍.(保留2位小数)
(4)某同学欲对用ClO2消毒过的水进行Cl-含量的测定.实验过程如下:向30.00mL水样中加几滴K2CrO4溶液作指示剂,用0.001000mol/L AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达到滴定终点,此时用去AgNO3溶液12.12mL,则:
①水样中Cl-的物质的量浓度是 ;
②如在滴定终点时,测得溶液中的CrO42-浓度是3.000×10-3mol/L,则此时溶液中Cl-的浓度为 .(已知KSP(AgCl)=1.77×10-10,KSP(Ag2CrO4)=2.70×10-12)
(5)(CN)2被称为拟卤素,CN-则被称为拟卤离子,它们的性质类似于卤素单质(如氯气)及卤素阴离子(如氯离子).
①写出(CN)2与NaOH溶液反应的离子反应式 .
②写出CN-的电子式 .
③已知1g气态(CN)2完全燃烧放出21.1kJ的热,写出(CN)2(g)在O2(g)中燃烧的热化学反应方程式 .
含有农药、染料、酚、氰化物,具有臭味的废水,常用氧化法进行处理.一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-离子)的废水.在碱性条件下(PH=8.5~11),氯气可将氰化物中CN-氧化为比它毒性小1000倍的氰酸盐(含CNO-).
(1)写出含CN-废水中用氯气氧化,生成氰酸盐时的离子方程式
(2)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,写出反应的离子方程式
(3)ClO2也可将剧毒氰化物氧化成无毒气体而除去,写出用ClO2氧化除去CN-的离子方程式
(4)某同学欲对用ClO2消毒过的水进行Cl-含量的测定.实验过程如下:向30.00mL水样中加几滴K2CrO4溶液作指示剂,用0.001000mol/L AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达到滴定终点,此时用去AgNO3溶液12.12mL,则:
①水样中Cl-的物质的量浓度是
②如在滴定终点时,测得溶液中的CrO42-浓度是3.000×10-3mol/L,则此时溶液中Cl-的浓度为
(5)(CN)2被称为拟卤素,CN-则被称为拟卤离子,它们的性质类似于卤素单质(如氯气)及卤素阴离子(如氯离子).
①写出(CN)2与NaOH溶液反应的离子反应式
②写出CN-的电子式
③已知1g气态(CN)2完全燃烧放出21.1kJ的热,写出(CN)2(g)在O2(g)中燃烧的热化学反应方程式
考点:探究物质的组成或测量物质的含量,离子方程式的书写,难溶电解质的溶解平衡及沉淀转化的本质,氯气的化学性质,氯、溴、碘及其化合物的综合应用
专题:元素及其化合物
分析:(1)含CN-废水中用氯气氧化,生成氰酸盐、氯离子、水;
(2)漂白粉处理含CN-的废水,若将其氧化为CNO-,同时生成氯离子;
(3)用ClO2氧化除去CN-,生成二氧化碳和氮气等无毒气体;利用化合价变化计算消毒效率;
(4)①由利用Ag++Cl-=AgCl↓计算水样中Cl-的物质的量及其浓度;
②当有砖红色Ag2CrO4沉淀出现时,达滴定终点,利用Ksp(Ag2CrO4)计算c(Ag+),再利用Ksp(AgCl)计算此时溶液中Cl-的浓度;
(5)①氯气与碱反应可知,发生(CN)2+2KOH=KCN+KCNO+H2O;
②氰(CN)2分子中各原子最外层均达到8电子稳定结构,则每个碳原子形成四个共价键,每个氮原子形成三个共价键,所以其结构式为N≡C-C≡N;
③1g气态(CN)2完全燃烧放出21.1kJ的热,则1molCN)2完全燃烧放出21.1kJ×52=1097.2kJ的热,以此来解答.
(2)漂白粉处理含CN-的废水,若将其氧化为CNO-,同时生成氯离子;
(3)用ClO2氧化除去CN-,生成二氧化碳和氮气等无毒气体;利用化合价变化计算消毒效率;
(4)①由利用Ag++Cl-=AgCl↓计算水样中Cl-的物质的量及其浓度;
②当有砖红色Ag2CrO4沉淀出现时,达滴定终点,利用Ksp(Ag2CrO4)计算c(Ag+),再利用Ksp(AgCl)计算此时溶液中Cl-的浓度;
(5)①氯气与碱反应可知,发生(CN)2+2KOH=KCN+KCNO+H2O;
②氰(CN)2分子中各原子最外层均达到8电子稳定结构,则每个碳原子形成四个共价键,每个氮原子形成三个共价键,所以其结构式为N≡C-C≡N;
③1g气态(CN)2完全燃烧放出21.1kJ的热,则1molCN)2完全燃烧放出21.1kJ×52=1097.2kJ的热,以此来解答.
解答:
解:(1)CN-废水中用氯气氧化,生成氰酸盐、氯离子、水,离子反应为CN-+2OH-+Cl2=CNO-+2Cl-+H2O,故答案为:CN-+2OH-+Cl2=CNO-+2Cl-+H2O;
(2)漂白粉处理含CN-的废水,若将其氧化为CNO-,同时生成氯离子,离子反应为CN-+ClO-=CNO-+Cl-,故答案为:CN-+ClO-=CNO-+Cl-;
(3)用ClO2氧化除去CN-,生成二氧化碳和氮气等无毒气体,离子反应为2ClO2+2CN-=2CO2↑+N2↑+2Cl-;ClO2消毒(氧化)效率是同质量消毒剂NaClO的
=2.76倍,故答案为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-;2.76;
(4)①由Ag++Cl-=AgCl↓可知,n(Cl-)=12.12×0.001L×0.001000mol?L-1=12.12×10-6mol,所以水样中c(Cl-)=
=4.04×10-4 mol?L-1,
故答案为:4.04×10-4 mol?L-1;
②当c(CrO42-)=5.00×10-3 mol?L-1出现砖红色沉淀时,由Ksp(Ag2CrO4)和 c(CrO42-)=5.00×10-3,得c(Ag+)=
=2.00×10-5 mol?L-1,
所以c(Cl-)=
=8.90×10-6 mol?L-1,故答案为:8.90×10-6 mol?L-1;
(5)①由Cl2+2KOH=KCl+KClO+H2O可知,(CN)2的化学性质和卤素很相似,则(CN)2与KOH(aq)反应的化学方程式为(CN)2+2KOH=KCN+KCNO+H2O,离子反应为(CN)2+2OH-═CN-+CNO -+H2O,故答案为:(CN)2+2OH-═CN-+CNO -+H2O;
②氰(CN)2分子中各原子最外层均达到8电子稳定结构,则每个碳原子形成四个共价键,每个氮原子形成三个共价键,所以其结构式为N≡C-C≡N,则CN-的电子式为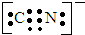 ,故答案为:
,故答案为: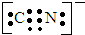 ;
;
③1g气态(CN)2完全燃烧放出21.1kJ的热,则1molCN)2完全燃烧放出21.1kJ×52=1097.2kJ的热,则热化学方程式为(CN)2(g)+2O2(g)=2CO2(g)+N2(g)△H=-1097.2kJ.mol-1,故答案为:(CN)2(g)+2O2(g)=2CO2(g)+N2(g)△H=-1097.2kJ.mol-1.
(2)漂白粉处理含CN-的废水,若将其氧化为CNO-,同时生成氯离子,离子反应为CN-+ClO-=CNO-+Cl-,故答案为:CN-+ClO-=CNO-+Cl-;
(3)用ClO2氧化除去CN-,生成二氧化碳和氮气等无毒气体,离子反应为2ClO2+2CN-=2CO2↑+N2↑+2Cl-;ClO2消毒(氧化)效率是同质量消毒剂NaClO的
| ||
|
(4)①由Ag++Cl-=AgCl↓可知,n(Cl-)=12.12×0.001L×0.001000mol?L-1=12.12×10-6mol,所以水样中c(Cl-)=
| 12.12×10-6mol |
| 30×10-3L |
故答案为:4.04×10-4 mol?L-1;
②当c(CrO42-)=5.00×10-3 mol?L-1出现砖红色沉淀时,由Ksp(Ag2CrO4)和 c(CrO42-)=5.00×10-3,得c(Ag+)=
|
所以c(Cl-)=
| 1.79×10-10 |
| 2.00×10-5 |
(5)①由Cl2+2KOH=KCl+KClO+H2O可知,(CN)2的化学性质和卤素很相似,则(CN)2与KOH(aq)反应的化学方程式为(CN)2+2KOH=KCN+KCNO+H2O,离子反应为(CN)2+2OH-═CN-+CNO -+H2O,故答案为:(CN)2+2OH-═CN-+CNO -+H2O;
②氰(CN)2分子中各原子最外层均达到8电子稳定结构,则每个碳原子形成四个共价键,每个氮原子形成三个共价键,所以其结构式为N≡C-C≡N,则CN-的电子式为
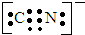 ,故答案为:
,故答案为: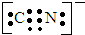 ;
;③1g气态(CN)2完全燃烧放出21.1kJ的热,则1molCN)2完全燃烧放出21.1kJ×52=1097.2kJ的热,则热化学方程式为(CN)2(g)+2O2(g)=2CO2(g)+N2(g)△H=-1097.2kJ.mol-1,故答案为:(CN)2(g)+2O2(g)=2CO2(g)+N2(g)△H=-1097.2kJ.mol-1.
点评:本题考查较综合,涉及物质含量的测定、氧化还原反应及溶度积的计算,把握习题中的信息及发生的氧化还原反应、Ksp的计算为解答的关键,(4)为解答的难点,侧重学生分析能力及计算能力的考查,题目难度中等.

练习册系列答案
相关题目
下列有关实验说法不正确的是( )
| A、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| B、向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2,检验火柴头中的氯元素 |
| C、在2mL紫色的CoCl2溶液中加入浓盐酸,可使溶液显蓝色 |
| D、制备摩尔盐时,最后在蒸发皿中蒸发浓缩溶液,加热至液体表面出现晶膜为止,不能将溶液全部蒸干 |
下列离子方程式中,错误的是( )
| A、氯气通入硝酸银溶液中:Cl2+H2O+Ag+→AgCl↓+H++HClO |
| B、用硫酸铜溶液吸收硫化氢气体:Cu2++S2-→CuS↓ |
| C、次氯酸钠溶液中通入少量二氧化碳:ClO-+H2O+CO2→HCO3-+HClO |
| D、向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-→BaCO3↓+CO32-+2H2O |
 在容积固定为2L的密闭容器中,充入0.18molHI,480℃时反应:
在容积固定为2L的密闭容器中,充入0.18molHI,480℃时反应: