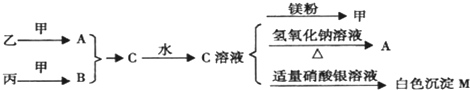
题目内容
在一定温度下,向容积固定不变的密闭容器里充入a mol NO2,发生如下反应:2NO2(g)A.平均相对分子质量增大
B.NO2的转化率提高
C.压强为原来的2倍
D.颜色变浅
CD
解析:增加NO2,平衡向正方向移动,所以NO2转化率变大,但NO2不可能全部转化为N2O4,压强不可能为原来的2倍,并且剩余c(NO2)变大,故颜色变深。

练习册系列答案
相关题目
在一定温度下,向容积为2L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0.有关该反应的描述正确的是( )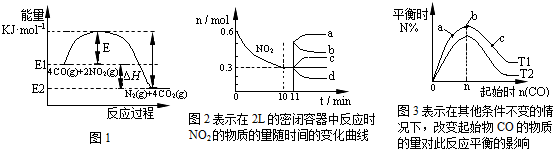

| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |