题目内容
18.从H+、Na+、Cu2+、Cl-、SO42- 5种离子中恰当地组成电解质,按下列要求进行电解:(1)以碳棒为电极进行电解,电解质质量减少,水量不变,则采用的电解质是CuCl2、HCl.
(2)以铂片为电极进行电解,电解质质量不变.水量减少,则采用的电解质是Na2SO4、H2SO4.
(3)以碳棒为阳极,铁棒为阴极,进行电解,电解质和水量都减少,则采用的电解质是CuSO4、NaCl.
分析 根据电解池的工作原理阳离子放电顺序为Cu2+>Na+>H+,阴离子放电顺序为Cl->OH->SO42-;
①碳棒是惰性电极,惰性电极电解溶质本身时,电解质质量减小,水量不变;
②惰性电极电解水时,电解质质量不变,水量减少;
③石墨棒为阳极,铁棒为阴极,电解质与水都参与电解时,电解质和水量都减少;
解答 解:因阳离子放电顺序为Cu2+>Na+>H+,阴离子放电顺序为Cl->OH->SO42-,则
①碳棒是惰性电极,惰性电极电解CuCl2溶液或者HCl溶液时,电解质质量减小,水量不变,故答案为:CuCl2、HCl;
②惰性电极电解Na2SO4溶液或者H2SO4溶液时,氢离子、氢氧根离子放电,则电解质质量不变,水量减少,故答案为:Na2SO4、H2SO4;
③石墨棒为阳极,铁棒为阴极,电解CuSO4、NaCl溶液时,则铜离子、氢氧根离子、氯离子、氢离子放电,所以电解质和水量都减少,故答案为:CuSO4、NaCl;
点评 本题考查电解原理以及应用知识,明确离子的放电顺序是解答本题的关键,注意电极材料与发生的电极反应即可解答,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
9.把10.6g碳酸钠溶于水制成100ml溶液,再从中取出10ml溶液,下列说法正确的是( )
| A. | 碳酸钠的物质的量浓度为0.1mol/L | B. | 碳酸钠的物质的量为0.1mol | ||
| C. | c(Na+)=0.2mol/L | D. | c(Na+)=2mol/L |
6.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14.则下列叙述正确的是( )
| A. | C(H+)随着温度升高而降低 | B. | 在35℃时,C(H+)>C(OH-) | ||
| C. | 水的电离度(25℃)>(35℃) | D. | 水的电离是吸热的 |
13.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
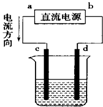

| A. | a为负极,b为正极 | B. | d为阳极,c为阴极 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
3.下列说法正确的是( )
| A. | 稀释浓硫酸时,将水沿器壁缓缓注入浓硫酸中 | |
| B. | 化学上分离出的杂质不是有害的就是没价值的 | |
| C. | 实验室取用液体药品时,如没有特殊说明用量,一般取1-2ml | |
| D. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
10.若7x%和x%的两种液体等体积混合,其质量分数大于4x%,此溶质可能是( )
| A. | H2SO4 | B. | NH3•H2O | C. | NaOH | D. | 乙醇 |
7.下面有关电化学的图示,完全正确的是( )
| A. | 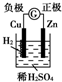 Cu-Zn原电池 | B. | 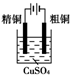 粗铜的精炼 | ||
| C. | 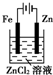 铁片镀锌 | D. | 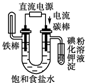 验证NnCl溶液(含酚酞) |
8.下列关于浓硝酸和浓硫酸的叙述正确的是( )
| A. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| B. | 浓硝酸具有不稳定性,实验室里应保存在棕色瓶中 | |
| C. | 常温下,浓硝酸可以跟铜缓慢反应,浓硫酸可与铜片迅速反应 | |
| D. | 实验室可以用浓硝酸来制氢气 |
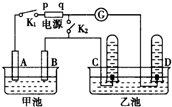 在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题: