题目内容
恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆
H2(g) +I2(g)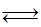 2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:

下列判断正确的
H2(g) +I2(g)
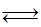 2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
下列判断正确的
| A.平衡时,乙中颜色更深,a>0.008 |
| B.平衡时,放出的热量:Q1=1/2Q2 =0.149kJ |
| C.该温度下,该反应的平衡常数K="4" |
| D.平衡后,向甲中再冲入0.004 mol HI气体,再次达到平衡时HI的百分含量不变 |
D
试题分析:A、乙容器的反应物浓度是甲容器反应物浓度的2倍,该反应是反应前后气体物质的量不变的可逆反应,所以恒温恒容时,压强的改变对该反应无影响,因此达平衡时乙容器的HI的浓度是甲容器HI的2倍,颜色加深但a=0.008,错误;B、可逆反应的反应物不会完全转化,所以平衡时,放出的热量:Q1=1/2Q2<0.149kJ,错误;C、该温度下,该反应的平衡常数K=0.0042/0.001×0.001=16,错误;D、平衡后,向甲中再冲入0.004 mol HI气体,相当于又增加了0.002mol的H2、I2,其物质的量比与开始时相同都为1:1,所以再达平衡时与原平衡等效,HI的百分含量不变,正确,答案选D。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
 CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
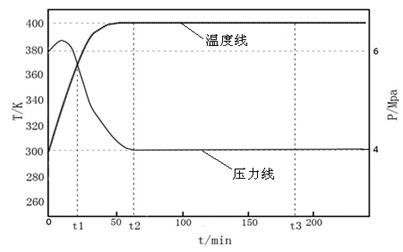
 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
 2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表: CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是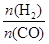 ]:当γ=2时,甲醇的选择性[λ =
]:当γ=2时,甲醇的选择性[λ =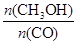 ]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式 。
]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式 。