题目内容
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。

①第1组实验中,导致反应后pH升高的原因是______________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________。
③第2组实验进行18 s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小
B.c(I-)减小
C.I2(g)不断生成
D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)
 I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。

| 编号 | 反应物 | 反应前pH | 反应前pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是______________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________。
③第2组实验进行18 s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小
B.c(I-)减小
C.I2(g)不断生成
D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
(1)O3(g)+2I-(aq)+2H+(aq)=O2(g)+I2(aq)+H2O(l) ΔH1+ΔH2+ΔH3
(2)K=
(3)①H+被消耗,其浓度降低 ②Fe2+ Fe3+氧化I-生成I2,使I-的转化率显著提高 ③BD
(4)反应时间:18 s-3 s=15 s,I3-浓度变化:11.8×10-3mol·L-1-3.5×10-3mol·L-3mol·L-1=8.3×10-3mol·L-1,v(I3-)=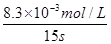 ≈5.5×10-4mol·(L·s)-1
≈5.5×10-4mol·(L·s)-1
(2)K=

(3)①H+被消耗,其浓度降低 ②Fe2+ Fe3+氧化I-生成I2,使I-的转化率显著提高 ③BD
(4)反应时间:18 s-3 s=15 s,I3-浓度变化:11.8×10-3mol·L-1-3.5×10-3mol·L-3mol·L-1=8.3×10-3mol·L-1,v(I3-)=
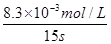 ≈5.5×10-4mol·(L·s)-1
≈5.5×10-4mol·(L·s)-1利用盖斯定律、化学反应速率、化学平衡的影响因素等分析及计算,逐步解决问题。
(1)根据盖斯定律,由①+②+③可得总反应为2I-(aq)+O3(g)+2H+(aq)=I2(aq)+O2(g)+H2O(l),则ΔH=ΔH1+ΔH2+ΔH3。(2)所给反应的平衡常数表达式为K= 。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图1中的A为Fe2+,由Fe3+生成Fe2+的过程中,I-被氧化为I2,因此I-的转化率显著提高。③导致I3-浓度下降的原因是c(Fe3+)增加,使c(I-)减小,平衡I2(aq)+I-(aq)??I3-(aq)逆向移动。(4)v(I3-)=
。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图1中的A为Fe2+,由Fe3+生成Fe2+的过程中,I-被氧化为I2,因此I-的转化率显著提高。③导致I3-浓度下降的原因是c(Fe3+)增加,使c(I-)减小,平衡I2(aq)+I-(aq)??I3-(aq)逆向移动。(4)v(I3-)=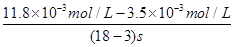 ≈5.5×10-4mol·(L·s)-1。
≈5.5×10-4mol·(L·s)-1。
点拨:知识:反应热、化学反应速率、化学平衡常数。能力:考查考生对化学反应原理的理解能力。试题难度:中等。
(1)根据盖斯定律,由①+②+③可得总反应为2I-(aq)+O3(g)+2H+(aq)=I2(aq)+O2(g)+H2O(l),则ΔH=ΔH1+ΔH2+ΔH3。(2)所给反应的平衡常数表达式为K=
 。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图1中的A为Fe2+,由Fe3+生成Fe2+的过程中,I-被氧化为I2,因此I-的转化率显著提高。③导致I3-浓度下降的原因是c(Fe3+)增加,使c(I-)减小,平衡I2(aq)+I-(aq)??I3-(aq)逆向移动。(4)v(I3-)=
。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图1中的A为Fe2+,由Fe3+生成Fe2+的过程中,I-被氧化为I2,因此I-的转化率显著提高。③导致I3-浓度下降的原因是c(Fe3+)增加,使c(I-)减小,平衡I2(aq)+I-(aq)??I3-(aq)逆向移动。(4)v(I3-)=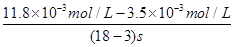 ≈5.5×10-4mol·(L·s)-1。
≈5.5×10-4mol·(L·s)-1。点拨:知识:反应热、化学反应速率、化学平衡常数。能力:考查考生对化学反应原理的理解能力。试题难度:中等。

练习册系列答案
相关题目
 2XY2
2XY2 2X2Y
2X2Y 2 CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2 CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。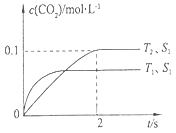

 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( ) 2XY2
2XY2 CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是( )
CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是( )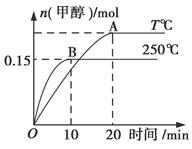
 2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( ) 2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。