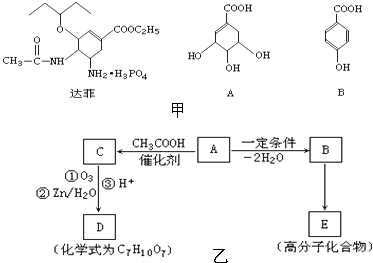
题目内容
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱。根据它们之间的转化关系(下图),回答下列问题: (部分反应物与产物已省略)

(1)写出下列物质的化学式: A______B________ D________
(2)A 与 SO3(g)的反应类似于 A 与 X 的反应,请写出 A 与 SO3(g)反应的化学方程式并标出该反应电子转移的方向和数目:___________________。
(3)向Z 溶液中通入足量的Cl2,写出检验Z 中阳离子所需试剂___________。
(4)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:______________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为____________。
【答案】 Na2O2 Na2CO3 NaOH 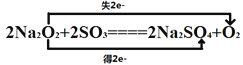 硫氰化钾溶液或KSCN 避免碳酸氢钠在温度过高时分解 n(Na2CO3):n(NaHCO3)=2:1
硫氰化钾溶液或KSCN 避免碳酸氢钠在温度过高时分解 n(Na2CO3):n(NaHCO3)=2:1
【解析】A为淡黄色固体化合物,X为无色气体,D为一种常见的强碱,并且X与D反应生成B溶液,所以X为酸性气体,B为盐,所以不难推出A是Na2O2,X为CO2,B为Na2CO3,C是O2,B与氢氧化钡生成D,则D为NaOH,Z为浅绿色溶液,说明含有亚铁离子,亚铁离子与NaOH溶液反应生成E为Fe(OH)2,Fe(OH)2与O2、水反应生F为Fe(OH)3。(1)通过以上分析知,A、B、D分别是Na2O2、Na2CO3、NaOH,(2)根据过氧化钠和二氧化碳的反应生成Na2CO3和O2,可以推知三氧化硫和过氧化钠反应生成硫酸钠和氧气,即2Na2O2+2SO3=2Na2SO4+O2,该反应中只有Na2O2中O元素的化合价发生变化,分别由﹣1价变化为0价和﹣2价,即转移电子数为2,用双线桥法表示电子转移方向和数目为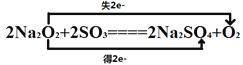 ;(3)Z为浅绿色溶液,说明含有亚铁离子,向Z溶液中通入足量的Cl2,离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣,故用硫氰化钾(KSCN)来检验Fe3+;(4)D为NaOH,X为CO2,向含NaOH溶液中通入一定量的CO2后,完全反应后,在低温条件下蒸发结晶,最终得到14.8g固体;①因为碳酸氢钠在温度过高时分解,所以蒸发结晶在低温条件下进行;②氢氧化钠的物质的量为:
;(3)Z为浅绿色溶液,说明含有亚铁离子,向Z溶液中通入足量的Cl2,离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣,故用硫氰化钾(KSCN)来检验Fe3+;(4)D为NaOH,X为CO2,向含NaOH溶液中通入一定量的CO2后,完全反应后,在低温条件下蒸发结晶,最终得到14.8g固体;①因为碳酸氢钠在温度过高时分解,所以蒸发结晶在低温条件下进行;②氢氧化钠的物质的量为: ![]() =0.25mol,假设生成Na2CO3的物质的量为xmol,生成NaHCO3的物质的量为ymol,则根据钠原子守恒,2x+y=0.25,根据固体质量106x+84y=14.8,解得x=0.1,y=0.05,所以所得固体中含有的物质为Na2CO3和NaHCO3,它们的物质的量之比为n(Na2CO3):n(NaHCO3)=2:1,故答案为:Na2CO3和NaHCO3;n(Na2CO3):n(NaHCO3)=2:1。
=0.25mol,假设生成Na2CO3的物质的量为xmol,生成NaHCO3的物质的量为ymol,则根据钠原子守恒,2x+y=0.25,根据固体质量106x+84y=14.8,解得x=0.1,y=0.05,所以所得固体中含有的物质为Na2CO3和NaHCO3,它们的物质的量之比为n(Na2CO3):n(NaHCO3)=2:1,故答案为:Na2CO3和NaHCO3;n(Na2CO3):n(NaHCO3)=2:1。

 名校课堂系列答案
名校课堂系列答案【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题;(回答问题时,均需使用元素的真实元素符号,不得使用数字编号)
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)②、⑤、⑥的离子半径由大到小的顺序为
(2)写出由①、②两元称组成,且①的质量分数最高的分子的电子式 ,
写出该化合物跟⑧的单质发生置换反应的化学方程式 .
(3)元素⑥的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式
(4)元素③有多种氧化物,其中甲的相对分子质量最小;元素④有多种单质,其中乙的相对分子质量最小.在一定条件下,将2L 甲气体与1.5L 乙气体均匀混合,若该混合气体被足量NaOH 溶液完全吸收(没有气体残留).所生成的含氧酸盐的化学式是 .