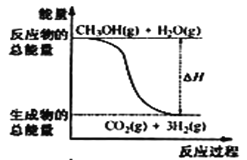
题目内容
【题目】写出下列反应的热化学方程式。
(1)已知断开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_______________________________
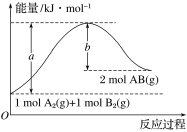
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:_______________________________________________
【答案】N2(g)+3H2(g)2NH3(g) △H=-92kJmol-1 A2(g)+B2(g)═2AB(g) △H=+(a-b)kJmol-1
【解析】
书写热化学方程式,应先写出化学方程式,标注物质的状态,再根据题目数据或图像计算反应热。
(1)在反应N2+3H22NH3中,断裂3molH-H键,1mol N≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)2NH3(g) △H=-92kJmol-1,故答案为:N2(g)+3H2(g)2NH3(g) △H=-92kJmol-1;
(2)图中吸收热量为(a-b)kJ,则热化学方程式为A2(g)+B2(g)═2AB(g) △H=+(a-b)kJmol-1,故答案为:A2(g)+B2(g)═2AB(g) △H=+(a-b)kJmol-1。

 应用题天天练四川大学出版社系列答案
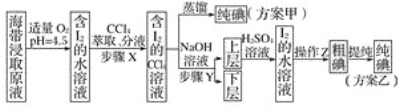
应用题天天练四川大学出版社系列答案【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
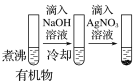
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D