题目内容
(10分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)用惰性电极电解硫酸铜溶液时,若某电解质量增加16g,则另一电极的电极方程式为___________;该电极可收集到标况下气体____________L。
(2)![]() 的立体构型是________,其中S原子的杂化轨道类型是_______;
的立体构型是________,其中S原子的杂化轨道类型是_______;
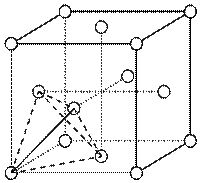
(3))元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______。
(1)4OH-- - 4e- ==2H2O + O2 ; 2.8L。 (2)正四面体,sp3;
(3))5d106s1; 3:1
解析:(1) 惰性电极电解硫酸铜溶液,阴极和阳极的反应式分别为2Cu2++4e-=2Cu、4OH--4 e-==2H2O+ O2 ↑,铜的物质的量是![]() ,根据电荷守恒定律知气体的体积是
,根据电荷守恒定律知气体的体积是![]() 。
。
(2)根据价层电子对互斥模型知,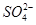 中中心原子的孤对电子数是0,价层电子对数是4,所以是正四面体构型,采用sp3杂化。
中中心原子的孤对电子数是0,价层电子对数是4,所以是正四面体构型,采用sp3杂化。
(3)立方体有6个面8个顶点,所以1个晶胞中含有的铜原子和金原子数分别为6×1/2=3,8×1/8=1,所以合金中Cu原子与Au原子数量之比为3:1。
(3)根据构造原理知Au原子最外层电子排布式为5d106s1(全充满或半充满最稳定)。

练习册系列答案
相关题目