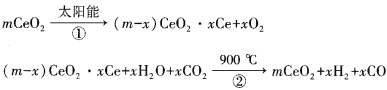题目内容
【题目】某化学兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题:
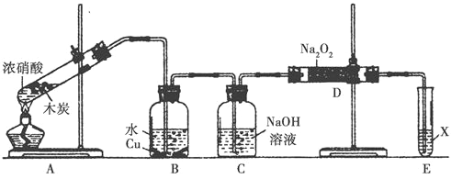
(1)组装好仪器后,必须进行的一项操作是_________________。
(2)装置A的试管中发生反应的化学方程式是_______________。
(3)推测B中可以观察到的主要现象是________;C装置的作用是________。
(4)装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是____________;为了不产生Y物质,可把C装置改为___________(填试剂和仪器名称)。
(5)在酸性溶液中,NO2-可将MnO4-还原为Mn2+。写出有关反应的离子方程式_______________。
(6)E装置中试剂X可以是________。
A.稀硫酸 B.酸性高锰酸钾溶液 C.稀硝酸 D.水
【答案】
(1)检查装置的气密性
(2)C+4HNO3(浓)![]() CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
(3)铜片逐渐溶解,溶液逐渐变蓝,产生无色气泡 除去NO中混有的CO2
(4)NaOH 装有碱石灰的干燥管
(5)5NO2-+2MnO4-+6H+ =5NO3-+2Mn2+ +3H2O (6)B
【解析】
试题分析:(1)组装好仪器后,必须进行的一项操作是检查装置的气密性;
(2)装置A的试管中发生反应的化学方程式是C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(3)根据装置图可知,A中产生的NO2在B中与水反应生成HNO3和NO,其中HNO3与铜反应,故铜片溶解,溶液变蓝,产生气泡;由于A中还产生了CO2,故在通入D之前应先用氢氧化钠溶液将其除去NO中混有的CO2;
(4)由于NO通过氢氧化钠溶液进入D装置时会带入水蒸气,根据原子守恒可知,生成的固体物质应该还有NaOH;若要避免生成NaOH,应该除去水蒸气,则改进方法为用装有碱石灰的干燥管代替C装置;
(5)在酸性溶液中,NO2-可将MnO4-还原为Mn2+,NO2-氧化生成NO3-,离子方程式为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
(6)通过酸性高锰酸钾溶液除去剩余一氧化氮,生成硝酸,防止污染空气,故选B。

 学习实践园地系列答案
学习实践园地系列答案【题目】t℃时,在体积不变的容器中发生反应:X(g)+3Y(g)![]() 2Z(g)△H<0;各组分浓度如下表:
2Z(g)△H<0;各组分浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L—1 | 0.1 | 0.3 | 0 |
2min末浓度/mol·L—1 | 0.08 | ||
平衡浓度/mol·L—1 | 0.1 |
下列说法不正确的是
A.0-2min的平均速率v(X)=0.01mol·L—1·min—1
B.达平衡时Y的转化率为50%
C.其它条件不变,升高温度,平衡逆向移动
D.其它条件不变,增加X的浓度,v正增大v逆减小,平衡正向移动