题目内容
15.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)?Y(g)+Z (s),以下不能作为反应达到平衡标志的是( )| A. | X的分解速率是Y的消耗速率 的2倍 | |
| B. | 混合气体的压强不再变化 | |
| C. | 混合气体的密度不再变化 | |
| D. | 单位时间内生成lmolY的同时分解2mol X |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、X的分解速率等效于Y的生成速率的2倍,与Y的消耗速率 的2倍相等,正逆反应速率相等,达平衡状态,故A正确;
B、随着反应的进行体系压强逐渐减小,容器内压强保持不变说明达平衡状态,故B正确;
C、混合气体的密度不再变化,说明气体的质量不变,达平衡状态,故C正确;
D、单位时间内生成lmolY的同时分解2mol X,都反映的正反应方向,未体现正与逆的关系,故D错误;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患.现有一碳素钢锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等,下面是清洗水垢的流程:
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
II.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
III.向洗液中加入Na2SO3溶液;
IV.清洗达标,用NaNO2溶液钝化锅炉.
(1)在步骤I中:
①用NaOH是为了溶解除去水垢中的SiO2,反应的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
②已知:20℃时溶解度/g
根据数据和化学平衡原理解释,加入Na2CO3的作用CaSO4在水中存在平衡CaSO4(s)?Ca2+(aq)+SO42-(aq),用Na2CO3溶液浸泡后,Ca2+与CO32-结合成更难溶的CaCO3,使上述平衡右移,CaSO4转化成CaCO3,然后用盐酸除去.
(2)在步骤II中:
①加入稀盐酸和少量NaF溶液能除掉的水垢是CaCO3、Mg(OH)2、Fe2O3、SiO2(填化学式).
②清洗过程中,溶解的Fe2O3会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(3)步骤III中,加入Na2SO3的目的是将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
□Fe+□NO${\;}_{2}^{-}$+□H2O═□N2↑+□Fe3O4+□
②下面检测钝化效果的方法合理的是ab(填序号).
a.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
b.在炉面上滴加酸性KSCN溶液,观察红色消失的时间
c.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间.
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
II.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
III.向洗液中加入Na2SO3溶液;
IV.清洗达标,用NaNO2溶液钝化锅炉.
(1)在步骤I中:
①用NaOH是为了溶解除去水垢中的SiO2,反应的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
②已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(2)在步骤II中:
①加入稀盐酸和少量NaF溶液能除掉的水垢是CaCO3、Mg(OH)2、Fe2O3、SiO2(填化学式).
②清洗过程中,溶解的Fe2O3会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(3)步骤III中,加入Na2SO3的目的是将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
□Fe+□NO${\;}_{2}^{-}$+□H2O═□N2↑+□Fe3O4+□
②下面检测钝化效果的方法合理的是ab(填序号).
a.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
b.在炉面上滴加酸性KSCN溶液,观察红色消失的时间
c.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间.
3.下列说法正确的是( )
| A. | 在化学反应中,原子重新组合时伴随着能量的变化 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
10.高纯度的氢氧化镁广泛应用于医药、电力等领域.镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图1:

已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
(1)向溶液Ⅰ中加入X的作用是调节溶液pH.
(2)向溶液Ⅰ中加入的两种试剂先后顺序是H2O2、MgO(填化学式).
(3)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)如图2是Mg2+转化率随温度t的变化示意图:
①t1前Mg2+转化率增大的原因是升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
②向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.

已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(2)向溶液Ⅰ中加入的两种试剂先后顺序是H2O2、MgO(填化学式).
(3)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)如图2是Mg2+转化率随温度t的变化示意图:
①t1前Mg2+转化率增大的原因是升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
②向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
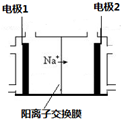 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,其中如图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是阴极,并写出电极1的电极反应式2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,其中如图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是阴极,并写出电极1的电极反应式2Cl--2e-=Cl2↑. 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为实验室制取蒸馏水的装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为实验室制取蒸馏水的装置.