题目内容
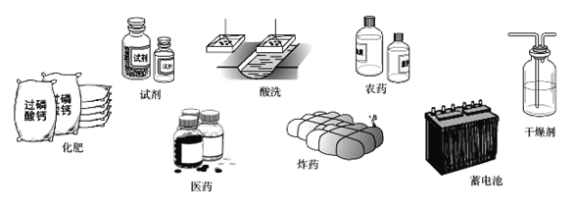
【题目】中国地质学家发现了一种新矿物,这种新矿物由X、Y、Z、W、R、T六种主族元素组成,其中X、Y、Z是金属元素,W、R、T是非金属元素。新矿物的化学式可表示为X3Y2(ZWR4)3T2;已知X和Z同主族,Y、Z、R、T同周期,T是非金属性最强的元素;Z原子的最外层电子数与次外层电子数相等,另外与R同主族的另一短周期表元素是Q,Q元素的最高氧化物对应水化物甲在工业上用途广泛,用途如下图,X与R的原子序数之和是W的2倍。
请回答下列问题
(1)W在元素周期表中的位置是 。
(2)Y、Z、R、T四种同周期元素中原子半径最大的是 (用元素符号表示,后同)。
(3)写出这种新矿物的化学式: 。
(4)写出由甲与XT2反应制T的氢化物的化学方程式 。
(5)在长途运输活鱼时,常在水中加入一定量的XR2,加入XR2的目的是杀菌消毒和 。
(6)由短周期元素组成的某些粒子,如SO2、O3、NO可互称为等电子体,则与Z同周期元素组成的粒子中,能与N3-、CS2互称为等电子体的粒子是一氧化二氮、二氟化铍和 (填符合要求粒子的名称)。
【答案】(1)第三周期IVA族 ;(2)Li ;(3)Ca3Li2(BeSiO4)3F2 ;
(4)CaF2+H2SO4(浓)![]() CaSO4+2HF;(5) 提供氧气;(6)二氧化碳。
CaSO4+2HF;(5) 提供氧气;(6)二氧化碳。
【解析】试题分析:T为非金属性最强的元素,则T为F元素;Y、Z、R、T为同周期元素,即处于第二周期,Z原子的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;R原子的最外层电子数为次外层电子数的3倍,R为O元素;X、Z为同主族元素,则X为Mg元素或Ca元素,若X为Mg元素,则由X与R原子序数之和是W的2倍,W原子序数为(12+8)÷2=10,为氖元素,不符合题意,若X为Ca元素,W原子序数为(20+8)÷2=14,符合题意,即X为Ca元素、W为Si,根据分析Q为S。(1)W为硅,位于周期表第三周期IVA族;(2)电子层数越多半径越大,相同电子层数,原子序数越小半径越大,Y、Z、R、T分被为Li、Be、O、F,故半径最大的为Li;(3)根据上述分析,该矿物的化学式为Ca3Li2(BeSiO4)3F2;(4)甲为硫酸,与XT2(CaF2)反应制HF的化学方程式为CaF2+H2SO4(浓)![]() CaSO4+2HF;;(5)在长途运输活鱼时,常在水中加入一定量的CaO2,与水和二氧化碳反应产生氧气,其目的是作为杀菌消毒和供氧剂;(6)等电子体为原子数相等,价电子总数也相等的微粒,则与Be同周期元素组成的微粒中,能与N3-、CS2互称为等电子体的微粒是二氧化碳。
CaSO4+2HF;;(5)在长途运输活鱼时,常在水中加入一定量的CaO2,与水和二氧化碳反应产生氧气,其目的是作为杀菌消毒和供氧剂;(6)等电子体为原子数相等,价电子总数也相等的微粒,则与Be同周期元素组成的微粒中,能与N3-、CS2互称为等电子体的微粒是二氧化碳。