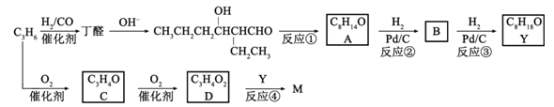
题目内容
【题目】7.4g有机物A完全燃烧生成8.96LCO2(标准状况下)和9g水,有机物B是A的同系物,1molB完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,B能与Na反应生成H2。
(1)B的分子式为___。
(2)若A不能发生催化氧化反应,则A的结构简式为___,若B不能发生消去反应,则B的结构简式为___。
(3)若A、B的另外一种同系物C既不能发生催化氧化反应,也不能发生消去反应,则C至少有__个碳原子。
【答案】C5H12O CH3C(OH)(CH3)2 HOCH2C(CH3)3 13
【解析】
(1)根据质量守恒计算与A完全燃烧参加反应氧气的质量,根据n=![]() 计算氧气、水的量物质的量,根据n=
计算氧气、水的量物质的量,根据n=![]() 计算二氧化碳的物质的量,根据原子守恒计算A分子中C、H原子数目,判断A分子中是否含有氧原子并计算氧原子数目,确定A的最简式,据此确定A的分子式;B与A互为同系物,1mol B完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,则B比A多1个CH2原子团,确定B的分子式;
计算二氧化碳的物质的量,根据原子守恒计算A分子中C、H原子数目,判断A分子中是否含有氧原子并计算氧原子数目,确定A的最简式,据此确定A的分子式;B与A互为同系物,1mol B完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,则B比A多1个CH2原子团,确定B的分子式;
(2)A不能发生催化氧化,若含有-OH,则羟基连接的碳原子上没有H原子,B能与钠反应生成氢气,B分子中至少含有-OH、-COOH中的一种,B不能发生消去反应,若含有羟基,则与羟基相连的碳原子相邻的碳原子上没有氢原子,结合分子式确定A、B结构;
(3)C既不能发生催化氧化反应,也不能发生消去反应,若含有羟基,羟基连接的碳原子上没有H原子,与羟基相连的碳原子相邻的碳原子上没有氢原子,则羟基相连的碳原子,至少还连接3个-C(CH3)3,结合有机物A、B的分子式确定C中碳原子个数。
(1)8.96L CO2(标准状况下)的物质的量为![]() =0.4mol,故n(C)=0.4mol,二氧化碳的质量为0.4mol×44g/mol=17.6g,A完全燃烧参加反应氧气的质量为17.6g+9g-7.4g=19.2g,氧气的物质的量为
=0.4mol,故n(C)=0.4mol,二氧化碳的质量为0.4mol×44g/mol=17.6g,A完全燃烧参加反应氧气的质量为17.6g+9g-7.4g=19.2g,氧气的物质的量为![]() =0.6mol,水的物质的量为
=0.6mol,水的物质的量为![]() =0.5mol,n(H)=1mol,根据氧原子守恒可知,7.4g有机物中n(O)=0.4mol×2+0.5mol-0.6mol×2=0.1mol,故n(C):n(H):n(O)=0.4mol:1mol:0.1mol=4:10:1,根据C、H原子关系可知,4个C原子中最多需要10个H原子,故A的分子式为C4H10O,B与A互为同系物,1mol B完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,则B比A多1个CH2原子团,B的分子式C5H12O。
=0.5mol,n(H)=1mol,根据氧原子守恒可知,7.4g有机物中n(O)=0.4mol×2+0.5mol-0.6mol×2=0.1mol,故n(C):n(H):n(O)=0.4mol:1mol:0.1mol=4:10:1,根据C、H原子关系可知,4个C原子中最多需要10个H原子,故A的分子式为C4H10O,B与A互为同系物,1mol B完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,则B比A多1个CH2原子团,B的分子式C5H12O。
答案为C5H12O。
(2)B能与钠反应生成氢气,B分子中含有-OH,有机物B是A的同系物,则A中含有羟基,A不能发生催化氧化,则羟基连接的碳原子上没有H原子,故A的结构简式为CH3C(OH)(CH3)2,B不能发生消去反应,则与羟基相连的碳原子相邻的碳原子上没有氢原子,则B为HOCH2C(CH3)3;
答案为CH3C(OH)(CH3)2;HOCH2C(CH3)3。
(3)若A、B的另外一种同系物C既不能发生催化氧化反应,也不能发生消去反应,羟基连接的碳原子上没有H原子,与羟基相连的碳原子相邻的碳原子上没有氢原子,则羟基相连的碳原子至少还连接3个-C(CH3)3,该同系物至少含有碳原子数目为4×3+1=13;
答案为13。

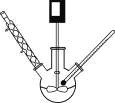
【题目】用50mL![]() 盐酸跟50mL
盐酸跟50mL![]() NaOH溶液中和反应过程中所放出的热量计算中和热。
NaOH溶液中和反应过程中所放出的热量计算中和热。
(1)烧杯间填满泡沫塑料的作用是______;
(2)大烧杯上若不盖硬纸板,求得的中和热数值______![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]()
(3)如图所示,仪器A的名称是______;

(4)重复三次实验,记录的实验数据如下:
实验用品 | 溶液温度 | |||
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
已知:![]() ,反应后溶液的比热容c为
,反应后溶液的比热容c为![]() ,各物质的密度均为
,各物质的密度均为![]() 。计算
。计算![]() ______
______![]()
(5)实验中改用80mL![]() 盐酸跟100mL
盐酸跟100mL![]() NaOH溶液进行反应,与上述实验相比,所放出的热量______
NaOH溶液进行反应,与上述实验相比,所放出的热量______![]() 填“相等、“不相等”
填“相等、“不相等”![]() ,所求中和热______
,所求中和热______![]() 填“相等、“不相等”
填“相等、“不相等”![]() 。
。