题目内容
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )
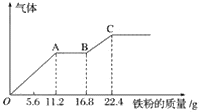
A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
【答案】BC
【解析】
由题意可知金属铜的物质的量为![]() =0.3mol,由铜和硝酸反应的方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子的物质的量=0.3mol×
=0.3mol,由铜和硝酸反应的方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子的物质的量=0.3mol×![]() =0.2mol;由图可知OA段发生的反应为:Fe+4H++NO3—=Fe3++NO↑+2H2O, AB段发生的反应为:2Fe3++Fe=Fe2+,BC段发生的反应为:Fe+2H+=Fe2++H2↑。
=0.2mol;由图可知OA段发生的反应为:Fe+4H++NO3—=Fe3++NO↑+2H2O, AB段发生的反应为:2Fe3++Fe=Fe2+,BC段发生的反应为:Fe+2H+=Fe2++H2↑。
A项、由图可知,OA段为铁与溶液中硝酸根反应、AB段为铁离子与铁反应、BC段为氢离子与铁反应,溶液中硝酸根全部转化为NO,最终得到硫酸亚铁溶液,故A正确;
B项、由图可知溶液中亚铁离子的物质的量为![]() =0.4mol,由电荷守恒可知,溶液中硫酸根的物质的量为0.4mol,则原溶液中硫酸浓度为
=0.4mol,由电荷守恒可知,溶液中硫酸根的物质的量为0.4mol,则原溶液中硫酸浓度为![]() =4mol/L,故B错误;
=4mol/L,故B错误;
C项、金属铜的物质的量为![]() =0.3mol,由铜和硝酸反应的方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子的物质的量=0.3mol×
=0.3mol,由铜和硝酸反应的方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子的物质的量=0.3mol×![]() =0.2mol,则原溶液硝酸根离子的物质的量为0.2 mol×2=0.4mol,故C错误;
=0.2mol,则原溶液硝酸根离子的物质的量为0.2 mol×2=0.4mol,故C错误;
D项、由图可知OA段发生的反应为:Fe+4H++NO3—=Fe3++NO↑+2H2O, AB段发生的反应为:2Fe3++Fe=Fe2+,BC段发生的反应为:Fe+2H+=Fe2++H2↑,则OA段产生的气体是一氧化氮,BC段产生的气体是氢气,故D正确;
故选BC。