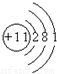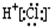题目内容
下列微粒结构的表达中,不正确的是( )
分析:A、乙烯分子中碳原子之间形成2对共用电子对,碳原子与氢原子之间形成1对共用电子对.用短线“-”代替共用电子对即为结构式,未成键孤对电子对不必标出.
B、钠原子质子数为11,核外有11个电子,有3个电子层,最外层电子数为1.
C、氮气分子中氮原子之间形成3对共用电子对.用短线“-”代替共用电子对即为结构式,未成键孤对电子对不必标出.
D、氯化氢是共价化合物,氯原子与氢原子之间形成1对共用电子对.
B、钠原子质子数为11,核外有11个电子,有3个电子层,最外层电子数为1.
C、氮气分子中氮原子之间形成3对共用电子对.用短线“-”代替共用电子对即为结构式,未成键孤对电子对不必标出.
D、氯化氢是共价化合物,氯原子与氢原子之间形成1对共用电子对.
解答:解:A、乙烯分子中碳原子之间形成2对共用电子对,碳原子与氢原子之间形成1对共用电子对,结构式为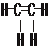 ,故A正确;
,故A正确;
B、钠原子质子数为11,核外有11个电子,有3个电子层,最外层电子数为1,原子结构示意图为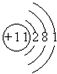 ,故B正确;
,故B正确;
C、氮气分子中氮原子之间形成3对共用电子对,结构式为N≡N,故C正确;
D、氯化氢是共价化合物,不存在离子键,氯原子与氢原子之间形成1对共用电子对,电子式为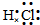 ,故D错误.
,故D错误.
故选:D.
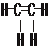 ,故A正确;
,故A正确;B、钠原子质子数为11,核外有11个电子,有3个电子层,最外层电子数为1,原子结构示意图为
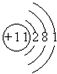 ,故B正确;
,故B正确;C、氮气分子中氮原子之间形成3对共用电子对,结构式为N≡N,故C正确;
D、氯化氢是共价化合物,不存在离子键,氯原子与氢原子之间形成1对共用电子对,电子式为
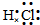 ,故D错误.
,故D错误.故选:D.
点评:考查常用化学用语的书写,难度不大,注意结构式与结构简式的区别,容易混淆.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
下列微粒结构的表达方式中,正确的是( )
A、钠离子的电子式: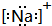 | B、氩原子的电子式: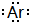 | C、硼原子的结构示意图: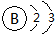 | D、氟离子的结构示意图: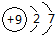 |