��Ŀ����
����Ŀ���������Ƴ�����Ư����ɱ��������������ˮ�Ͷ�����̼�����ʷ�����Ӧ�����治�����ױ��ʡ�ij��ȤС���Թ�������Ϊ�����������̽����
̽��һ�� �������CO2������Na2O2��Ӧ���͡�CO2����ˮ����ʱ������Na2O2��Ӧ�����������ʵ��װ�ã�
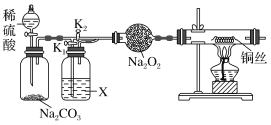
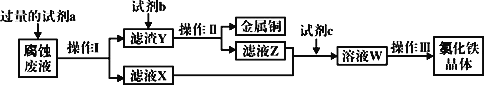
(1)����װ�ã���������ԡ��ڸ������װ��Na2O2��������ϡ���ᣬ����CO2����K1���ر�K2��һ��ʱ����ټ���ͭ˿�����У�X��Ӧ�����Լ�_____________(������)����ͨһ��ʱ��CO2��Ŀ����____________________________________��ʵ��۲쵽ͭ˿δ�仯����ó����ۡ������CO2������Na2O2��Ӧ����
(2)����K2���ر�K1������_____________________________����֤������ˮʱCO2��Na2O2��Ӧ��������O2��
̽������Na2O2�Ƿ��Ѿ����ʲ����Բⶨ����Ʒ��Na2O2����������
(3)��ͬѧΪ���Բⶨ����Ʒ��Na2O2��������������ȡm g��Ʒ���������װ�ý���ʵ�飺
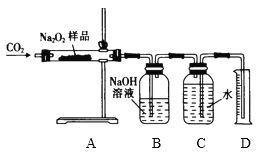
ʵ�鿪ʼ��A�з�����Ӧ�Ļ�ѧ����ʽΪ��______________________________������װ��B��ȥ�������δ��Ӧ��CO2������װ��C��D��Һ��߶���ͬ��������ͲD��ˮ����������������������������Ϊn g�������Ʒ��Na2O2����������Ϊ��____________________________��
���𰸡�Ũ���� ��װ���ڵ������ų�����ֹ����ͭ��Ӧ����ʵ�� ͭ˿�ɺ��� 2 Na2O2��2 CO2=2 Na2CO3��O2�� ![]()
��������
(1)Ҫ֤�������CO2������Na2O2��Ӧ���Լ�XӦ�Ǹ������װ���к��п�������������ʵ�飻
(2) ����K2���ر�K1���������̼�����к���ˮ������
(3) A�й��������������̼��Ӧ����̼���ƺ����������ݷ�Ӧ����ʽ����������Ƶ�������
(1)Ҫ֤�������CO2������Na2O2��Ӧ���Լ�XӦ�Ǹ��������X��Ũ���װ���к��п�������������ʵ�飬������ͨһ��ʱ��CO2��Ŀ���ǣ���װ���ڵ������ų�����ֹ����ͭ��Ӧ����ʵ�飻
(2) ����K2���ر�K1���������̼�����к���ˮ��������ͭ˿�ɺ��ڣ�֤������ˮʱCO2��Na2O2��Ӧ��������O2��
(3) A�й��������������̼��Ӧ����̼���ƺ���������Ӧ����ʽ��2Na2O2��2CO2=2 Na2CO3��O2����
����Ʒ��Na2O2��������xg��
2Na2O2��2CO2=2 Na2CO3��O2��
156 32
xg ng
![]() ��n=
��n=![]() g��
g��
����Ʒ��Na2O2����������Ϊ![]() g��m g��100%=
g��m g��100%=![]() ��
��