题目内容
18.微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是( )| A. | C3H6、CH2═CHCH3 | B. | H2O2、 | C. |  | D. |  1S22S22p63S23p6 1S22S22p63S23p6 |
分析 A、C3H6可以代表环丙烷、CH2═CHCH3是丙烯;
B、H2O2是双氧水的分子式、 是双氧水的电子式;
是双氧水的电子式;
C、 ,前者是甲烷、后者是四氯化碳;
,前者是甲烷、后者是四氯化碳;
D、 是Ne的原子结构示意图,1S22S22p63S23p6可能是K+、Cl-等.
是Ne的原子结构示意图,1S22S22p63S23p6可能是K+、Cl-等.
解答 解:A、C3H6可以代表环丙烷、CH2═CHCH3是丙烯,二者不是同种微粒,故A错误;
B、H2O2是双氧水的分子式、 是双氧水的电子式,二者一定代表同种微粒,故B正确;
是双氧水的电子式,二者一定代表同种微粒,故B正确;
C、 ,前者是甲烷、后者是四氯化碳,二者不是同种微粒,故C错误;
,前者是甲烷、后者是四氯化碳,二者不是同种微粒,故C错误;
D、 是Ne的原子结构示意图,1S22S22p63S23p6可能是K+、Cl-等,二者不是同种微粒,故D错误;
是Ne的原子结构示意图,1S22S22p63S23p6可能是K+、Cl-等,二者不是同种微粒,故D错误;
故选B.
点评 本题考查微粒的表示方法及其意义,难度不大,掌握其定义和特征是解题的关键,注意同分异构体和同种物质的区别.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
11.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:

下列说法正确的是( )

下列说法正确的是( )
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | CO和O生成了具有极性共价键的CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
12.某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验(一) 碘含量的测定

取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E) 反映溶液中c(I-)的变化,部分数据如表:
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH═5NaI+NaIO3+3H2O
请回答:
(1)实验(一)中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%%.
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分为上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
实验(一) 碘含量的测定

取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E) 反映溶液中c(I-)的变化,部分数据如表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH═5NaI+NaIO3+3H2O
请回答:
(1)实验(一)中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%%.
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分为上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
3.某化学反应过程如图所示.由图得出的判断错误的是( )
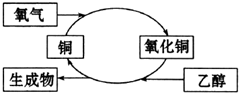

| A. | 生成物是乙醛 | B. | 乙醇发生了还原反应 | ||
| C. | 铜是此反应的催化剂 | D. | 反应中有红黑颜色交替变化的现象 |
10.已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12.下列关于该温度下的叙述正确的是( )
| A. | 向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl)减小 | |
| B. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| C. | 若向0.0008mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42--完全沉淀 | |
| D. | 若将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
7. O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:
O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:
反应Ⅰ:O3+2I-+2H+=I2+O2+H2O
(1)用双线桥标示反应Ⅰ的电子转移情况 .
.
(2)I2可以继续与I-发生反应Ⅱ:I2(aq)+I-(aq)?I3-(aq)△H,为探究外在条件对I3-生成速率的影响,做了如下三组实验,完成表中的内容(表中不要留空格):
(3)用离子色谱仪测定I3-浓度随时间变化如图所示:
①反应Ⅱ的△H<0(填“>”“<”或“=”)
②实验B 10s内,I3-的生成速率为8.8×10-4mol/(L.s).
③实验B 18s后,I3-生成速率降低的主要原因是I-浓度降低.
(4)为进一步探究FeCl2对I3-生成速率的影响,提出合理假设,
假设一:Fe2+对反应起催化作用;
假设二:Cl-对反应起催化作用.
(5)请你设计实验验证上述假设一,写出实验步骤及结论.
实验步骤及结论:取一定量NaI溶液,加入稀硫酸调节pH=5.2,将溶液均分为两份A和B,向A、B试管中分解加入等物质的量的FeSO4、Na2SO4固体少许,之后同时向两支试管中通入O3,用离子色谱仪测定10s后I3-浓度,若cA(I3-)>cB(I3-),说明假设一成立,若cA(I3-)=cB(I3-),则假设一不成立.
 O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:
O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:反应Ⅰ:O3+2I-+2H+=I2+O2+H2O
(1)用双线桥标示反应Ⅰ的电子转移情况
 .
.(2)I2可以继续与I-发生反应Ⅱ:I2(aq)+I-(aq)?I3-(aq)△H,为探究外在条件对I3-生成速率的影响,做了如下三组实验,完成表中的内容(表中不要留空格):
| 实验编号 | 实验目的 | 反应物 | 温度 | 反应前溶液的pH |
| A | 对照组 | O3+NaI+H2SO4 | 25℃ | 5.2 |
| B | 研究FeCl2对I3-生成速率的影响 | O3+NaI+H2SO4+FeCl2 | 25℃ | 5.2 |
| C | 研究温度对I3-生成速率的影响 | O3+NaI+H2SO4 | 5℃ | 5.2 |
①反应Ⅱ的△H<0(填“>”“<”或“=”)
②实验B 10s内,I3-的生成速率为8.8×10-4mol/(L.s).
③实验B 18s后,I3-生成速率降低的主要原因是I-浓度降低.
(4)为进一步探究FeCl2对I3-生成速率的影响,提出合理假设,
假设一:Fe2+对反应起催化作用;
假设二:Cl-对反应起催化作用.
(5)请你设计实验验证上述假设一,写出实验步骤及结论.
实验步骤及结论:取一定量NaI溶液,加入稀硫酸调节pH=5.2,将溶液均分为两份A和B,向A、B试管中分解加入等物质的量的FeSO4、Na2SO4固体少许,之后同时向两支试管中通入O3,用离子色谱仪测定10s后I3-浓度,若cA(I3-)>cB(I3-),说明假设一成立,若cA(I3-)=cB(I3-),则假设一不成立.
8.化学与社会、生活密切相关.下列事实、现象或解释都正确的是( )
| 选项 | 事实 | 现象或解释 |
| A | 不法分子燃烧硫磺熏制银耳 | 二氧化硫有还原性 |
| B | 可用浓氨水检验输送煤气的管道是否有泄漏 | 出现白烟处是煤气泄漏点 |
| C | 泡沫灭火器使用的物质是硫酸铝和碳酸钠 | 二者混合发生双水解反应生成二氧化碳和氢氧化铝 |
| D | 医院里常用来紫外线灯进行杀菌消毒 | 紫外线能使蛋白质变性 |
| A. | A | B. | B | C. | C | D. | D |