题目内容
【题目】按要求填空:
(1)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3溶度积Ksp=1.0×10-32,要使c(Cr3+)完全沉淀,溶液的pH应调至______。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为_________,由水电离出的c(OH-)=________mol·L-1。
(3)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为_____。
【答案】5 CO32 + H2OHCO3- + OH- 1×103 1:10
【解析】
(1)根据Cr(OH)3溶度积计算要使c(Cr3+)完全沉淀时的氢氧根浓度,再计算氢离子浓度和pH值。
(2)碳酸钠溶液pH为11,是碳酸根水解生成碳酸氢根和氢氧根,先计算溶液中c(H+),再计算溶液中c(OH-),溶液中的氢氧根就是水电离出的氢氧根。
(3)计算出100℃时pH=3的硫酸溶液c(H+)和pH=10的NaOH溶液c(OH-),根据混合后溶液的pH=7,溶液呈碱性进行计算。
(1)常温下,Cr(OH)3溶度积Ksp=1.0×1032,要使c(Cr3+)完全沉淀,![]() ,
,![]() ,
,![]() ,pH =5,因此溶液的pH应调至5;故答案为:5。
,pH =5,因此溶液的pH应调至5;故答案为:5。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,是碳酸根水解生成碳酸氢根和氢氧根,其水解方程式为CO32 + H2OHCO3- + OH-,c(H+)=1×1011molL1,c(OH-)=1×103 molL1,溶液中的氢氧根就是水电离出的氢氧根,因此由水电离出的c(OH-)=1×103molL1;故答案为:CO32 + H2OHCO3- + OH-;1×103。
(3)在100℃下,将pH=3的硫酸溶液c(H+)=1×103molL1,pH=10的NaOH溶液c(OH-)=1×102 molL1混合,若要使混合后溶液的pH=7,溶液呈碱性,c(OH-)=1×105 molL1,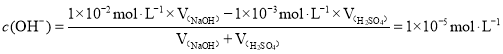 ,
,![]() ,则硫酸溶液和NaOH溶液的体积比约为1:10;故答案为:1:10。
,则硫酸溶液和NaOH溶液的体积比约为1:10;故答案为:1:10。

【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
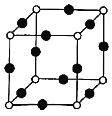
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。