题目内容
【题目】燃煤和汽车尾气是造成空气污染和雾霾天气的原因之一,化学在解决雾霾污染中发挥了重要作用。
(1)NOx主要来源于汽车尾气。
已知:N2(g) + 2O2(g)![]() 2NO2(g) ΔH=+67.5kJ/mol
2NO2(g) ΔH=+67.5kJ/mol
2CO(g) + O2(g)![]() 2CO2(g) ΔH=-566.0kJ/mol。
2CO2(g) ΔH=-566.0kJ/mol。
为了减轻大气污染,在汽车尾气排气管口采用催化剂将NO2和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式_____________。
(2)已知:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),工业上可以利用I2O5消除CO的污染。不同温度下,向装有足量I2O5固体的4 L恒容密闭容器中通入2 mol CO,测得CO2的体积分数随时间变化的曲线如图。回答下列问题:
5CO2(g)+I2(s),工业上可以利用I2O5消除CO的污染。不同温度下,向装有足量I2O5固体的4 L恒容密闭容器中通入2 mol CO,测得CO2的体积分数随时间变化的曲线如图。回答下列问题:

①从反应开始至a点时,v(CO)=___________。
②由图可知,该反应的ΔH________0(填“大于”或“小于”),b点时化学平衡常数K=___________。
③下列说法正确的是___________(填字母)。
A.d点时,增大体系压强,CO的转化率变大
B.容器内气体密度不变时,表明反应达到平衡状态
C.c点时体系中混合气体的压强在T2温度下更大
D.b点时,向平衡体系中再加入I2O5,平衡向正反应方向移动
(3)电解吸收是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。
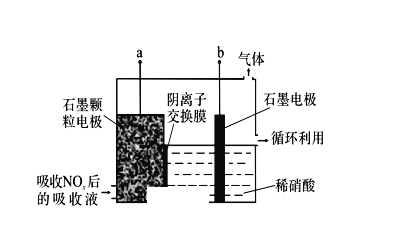
①图中b应连接电源的___________(填“正极”或“负极”)。
②阳极的电极反应式为___________。
【答案】 2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH=-1199.5 kJ/mol 0.4 mol/(L·min) 小于 1024 BC 负极 HNO2-2e-+H2O=NO3-+3H+
【解析】(1)NO2和CO在催化剂作用下发生氧化还原反应,生成无污染的氮气和二氧化碳,已知:①N2(g) + 2O2(g)![]() 2NO2(g) ΔH=+67.5kJ/mol ,②2CO(g) + O2(g)
2NO2(g) ΔH=+67.5kJ/mol ,②2CO(g) + O2(g)![]() 2CO2(g) ΔH=-566.0kJ/mol,由盖斯定律可知,②×2—①即得NO2和CO转化为氮气和二氧化碳的热化学方程式,2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH=-1199.5 kJ/mol。
2CO2(g) ΔH=-566.0kJ/mol,由盖斯定律可知,②×2—①即得NO2和CO转化为氮气和二氧化碳的热化学方程式,2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH=-1199.5 kJ/mol。
(2)①设转化的CO物质的量浓度为x,根据三段式进行计算:
5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始浓度(mol/L) 0.5 0
转化浓度(mol/L) x x
平衡浓度(mol/L) 0.5—x x
a点CO2的体积分数为0.4,则x/0.5=0.4,可得x=0.2 mol/L,则v(CO)=0.2mol/L÷0.5min = 0.4mol·L-1·min-1;
②图中d点先达到平衡,b点后达到平衡,说明T2大于T1,但CO2的体积分数反而小,说明升高温度,平衡逆向移动,则正反应是放热反应,即ΔH小于0;类似a点计算,可求出b点CO的平衡浓度为0.1 mol/L,CO2的 平衡浓度为0. 4mol/L,则b点时化学平衡常数Kb=c5(CO2)÷c5(CO)==45=1024。
③A.由于反应前后气体分子数不变即压强不变,在d点,其它条件不变时,增大体系压强,平衡不移动,CO的转化率不变,错误;B.容器内气体密度不变,说明气体的质量不变,则反应达到平衡状态,正确;C.因T2大于T1,且反应前后气体分子数不变,则c点时体系中混合气体的压强在T2温度下更大,正确;D.b点时,向平衡体系中加入I2O5是固体,不影响平衡移动,错误。故BC正确。
(3)①a电极上亚硝酸失电子生成硝酸,b电极上氢离子得电子生成氢气,所以a为阳极,b为阴极,则b与电源的负极相连;故答案为:负极;②阳极上亚硝酸失电子生成硝酸,其电极方程式为:HNO2-2e-+H2O=NO3-+3H+。

 名校课堂系列答案
名校课堂系列答案