题目内容
关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
A.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
C.已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=4.0×10-4
Fe3++3H2O的平衡常数K=4.0×10-4
D.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)为1.8×10-5mol?L-1
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的 错误是 由此造成的测定结果 (偏高、偏低或无影响)
错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是 。
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL

(6)请计算待测烧碱溶液的浓度 mol/L。
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前度数(mL) | 滴定后度数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
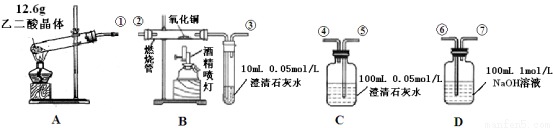
下列关于物质分类的正确组合是( )
酸 | 碱 | 盐 | 酸性氧化物 | 电解质 | |
A | H2SO4 | Na2CO3 | CaCO3 | CO2 | Cu |
B | NaHSO4 | NaOH | NH4Cl | SO2 | BaSO4 |
C | CH3COOH | NaOH | CaF2 | CO | SO3 |
D | HNO3 | KOH | NaHCO3 | SO3[ | NaCl |



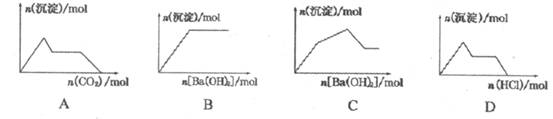

 3H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。
3H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。