题目内容
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )
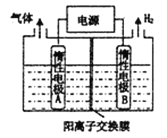
A. B极区电解液为LiOH溶液
B. 每产生2.24L氢气,就有0.2 mol阳离子通过交换膜进入阴极区
C. 电解过程中Li+向B电极迁移
D. 阳极电极反应式为2Cl--2e-=Cl2↑
【答案】B
【解析】
由图可知:B电极上有H2生成,则B为电解池的阴极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,A为阳极,阳极反应式为2Cl--2e-=Cl2↑,左侧电解液为LiCl溶液,右侧电解液为LiOH溶液。
A项,根据分析可知B极区电解质溶液为LiOH溶液,故A项正确;
B项,标准状况下,2.24L氢气的物质的量为0.1mol,根据电极反应式可知转移0.2mol电子,阴极得电子,为了维持溶液电中性,有0.2mol带正电荷的阳离子(Li+)通过交换膜进入阴极区,由于没有指明是标准状况,故B项错误;
C项,电解池工作时,电解质溶液中的阳离子向阴极移动,即Li+向B电极迁移,故C项正确;
D项,A电极为阳极,电极上Cl-放电,电极反应式为2Cl--2e-=Cl2↑,故D项正确。
综上所述,本题正确答案为B。

【题目】在一定温度下,10 mL 4.0 mol/L H2O2发生分解:2H2O2![]() H2O+ O2
H2O+ O2![]() ,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述正确的是(溶液体积变化忽略不计)
A. 6 min时反应速率υ(H2O2) = 3.33×10-2 mol/(L·mol)
B. 反应到6 min时,H2O2分解率为50%
C. 其他条件不变,若换用更高效的催化剂,达到平衡时将会得到更多氧气
D. 随时间增长得到的氧气更多,说明反应速率逐渐加快
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________