题目内容
一定温度下,下列溶液的粒子关系式正确的是 ( )
A、PH=5的H2S溶液中,C(H+)=C(HS—)=1×10—5mol/L
B、PH=8的氨水溶液,稀释后,n(H+)与n(OH—)的乘积变大
C、PH=1的NaHSO4溶液中:C(H+)=2C(SO42—)+C(OH—)
D、PH=8的NaHCO3溶液中:c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+)
练习册系列答案
相关题目
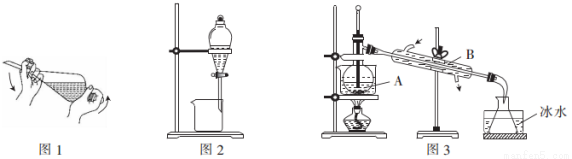
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
已知:

密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12. 5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 
②试管C置于冰水浴中的目的是 .
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后用 (填入编号)洗涤.
a.KMnO4溶液  b.稀H2SO4 c.Na2CO3溶液
b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从 口进入,目的是
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 .
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点


 Ka= 1.7×10—5 mol/L )可使溶液A和溶液B的PH相等的方法是
Ka= 1.7×10—5 mol/L )可使溶液A和溶液B的PH相等的方法是