题目内容
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
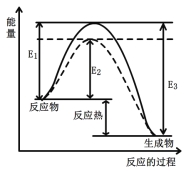

图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式 (热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 _______(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 _____(填“增大”、“不变”或“减小”)。
【答案】(1)CO(g)+2H2(g)![]() CH3OH(g)ΔH=(E1-E3)或-(E3-E1)kJmol-1
CH3OH(g)ΔH=(E1-E3)或-(E3-E1)kJmol-1
(2)加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等(任答一个合理答案给分。注:t1时刻不能确认是否平衡)
(3)CD(4)![]() ;正向移动;增大;
;正向移动;增大;
【解析】
试题分析:(1)图象分析反应是放热反应,反应的焓变=断裂化学键吸收的能量-形成化学键放出的热量=E1-E3,标注物质的聚集状态和对应反应的焓变写出热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g)△H=(E1-E3)或-(E3-E1)kJmol-1 ,故答案为:CO(g)+2H2(g)
CH3OH(g)△H=(E1-E3)或-(E3-E1)kJmol-1 ,故答案为:CO(g)+2H2(g)![]() CH3OH(g)△H=(E1-E3)或-(E3-E1)kJmol-1 ;
CH3OH(g)△H=(E1-E3)或-(E3-E1)kJmol-1 ;
(2)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合,如加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等,故答案为:加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等;
(3)判断反应达到平衡状态的依据正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;A.v逆(H2)=2v正(CO),说明正逆反应速率相同,2v逆(H2)=v正(CO)不能说明正逆反应速率相同,故A错误;B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故B错误;C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故C正确;D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故D正确;E.容器内CO、H2、CH3OH的浓度之比为1:2:1,和起始量,变化量有关,不能作为平衡的标志,故E错误;故选CD。
(4)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,依据平衡三段式列式计算;
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol/L) a 2a 0
变化量(mol/L)50%×a a 0.5a
平衡量(mol/L)0.5a a 0.5a
则该反应的平衡常数K=![]() =
=![]() ;若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,浓度为c(CO)=
;若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,浓度为c(CO)=![]() mol/L+0.5amol/L=amol/L,c(H2)=
mol/L+0.5amol/L=amol/L,c(H2)=![]() mol/L+amol/L=2a,c(CH3OH)=
mol/L+amol/L=2a,c(CH3OH)=![]() mol/L+0.5amol/L=amol/L,Q=
mol/L+0.5amol/L=amol/L,Q=![]() =
=![]() <K=
<K=![]() ,判断平衡移动的方向是反应正向进行;达到新平衡与原平衡相比,CO的物质的量浓度增大;故答案为:
,判断平衡移动的方向是反应正向进行;达到新平衡与原平衡相比,CO的物质的量浓度增大;故答案为:![]() ;正向移动;增大。
;正向移动;增大。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】下表各组物质之间通过一步反应不可以实现如图所示的转化
关系是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
C | Fe2O3 | FeCl3 | Fe(OH)3 | ④加入盐酸 |
D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
