题目内容
【题目】(工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用 (选填序号)。
a.KSCN溶水 b.KSCN溶液和铁粉
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应: SO2+Br2+2H2O=2HBr+H2SO4, 然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
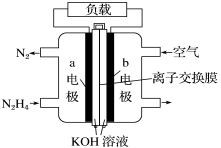
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是 。
【答案】(1)铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应
(2)①d ②66.7%(或2/3)(3)检验SO2是否除尽
(4)C+2H2SO4(浓)![]() CO2+2SO2+2H2O(5)c
CO2+2SO2+2H2O(5)c
(6)D中固体由黑变红和E中固体由白变蓝
【解析】
试题分析:(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,金属铁发生钝化你,表面形成致密的氧化膜,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,铁被氧化膜包围,阻止金属铁与铜离子发生置换反应。(20)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,氧化膜被破坏,铁和浓硫酸充分应后得到溶液可能为FeSO4 或 Fe2(SO4)3 或FeSO4 和 Fe2(SO4)3混合液,并收集到H2气体SO2 气体,随着反应进行,浓硫酸变为稀硫酸与铁继续反应生成 H2。,气体Y可能为SO2和H2的混合气体;
①Fe3+检验可以用KSCN溶液,Fe2+具有还原性,可以用酸性KMnO4溶液,氨水和Fe3+ 和Fe2+都能发生反应,生成沉淀,无法判断Fe2+的存在
②SO2+Br2+2H2O=2HBr+H2SO4, 然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g硫酸钡,折算为 0.01 mol,n(SO2)=0.01mol,,混合气体为0.015 mol,由此推知气体Y中SO2的体积分数为0.01/0.015=2/3;
(3)酸性高锰酸钾溶液能够吸收SO2,吸收是否完全,用品红检验;氢气能够还原氧化铜,黑色粉末变为红色,无水硫酸铜变为蓝色晶体,证明有氢气存在;铁中混有碳单质,在加热情况下,碳与浓硫酸反应生成二氧化碳,生成的气体中可能含有SO2 、H2 、CO2等气体的混合气体。为确认CO2的存在,需在装置中添加M于B-C间,SO2已经除尽,能够使石灰水变浑浊的气体只能为CO2

 阅读快车系列答案
阅读快车系列答案