题目内容
下列说法中正确的是( )
分析:A、粗铜中铜是电子发生氧化反应,含有的锌、铁也会失电子发生氧化反应,依据电子守恒分析判断;
B、水的电离是吸热过程,升温促进水的电离,水的离子积常数增大;
C、100°C离子积常数增大中性溶液PH小于7;
D、过量的氢氧化钠溶液和碳酸氢根离子、铵根离子反应.
B、水的电离是吸热过程,升温促进水的电离,水的离子积常数增大;
C、100°C离子积常数增大中性溶液PH小于7;
D、过量的氢氧化钠溶液和碳酸氢根离子、铵根离子反应.
解答:解:A、粗铜中铜是电子发生氧化反应,含有的锌、铁也会失电子发生氧化反应,依据电子守恒分析判断,溶液中铜离子浓度减小,故A错误;
B、水的电离是吸热过程,升温促进水的电离,水的离子积常数增大,20℃稀NaOH溶液的Kw小于80℃稀H2SO4溶液的Kw,故B错误;
C、100°C离子积常数增大中性溶液PH小于7,100℃pH=2的H2SO4溶液与100℃pH=12的NaOH溶液等体积混合,碱过量溶液显碱性,故C正确;
D、往NH4HCO3溶液中加过量NaOH溶液的离子方程式为:NH4++HCO3-+2OH-=NH3?H2O+H2O+CO32-,故D错误;
故选C.
B、水的电离是吸热过程,升温促进水的电离,水的离子积常数增大,20℃稀NaOH溶液的Kw小于80℃稀H2SO4溶液的Kw,故B错误;
C、100°C离子积常数增大中性溶液PH小于7,100℃pH=2的H2SO4溶液与100℃pH=12的NaOH溶液等体积混合,碱过量溶液显碱性,故C正确;
D、往NH4HCO3溶液中加过量NaOH溶液的离子方程式为:NH4++HCO3-+2OH-=NH3?H2O+H2O+CO32-,故D错误;
故选C.
点评:本题考查了电解原理分析应用,水的电离平衡影响因素分析,离子积常数的分析应用,离子方程式书写量不同产物不同,题目难度中等.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、进行钠的有关性质实验时,用剩的钠应放回原试剂瓶 | B、常用25.00 ml 碱式滴定管准确量取20.00 ml KMnO4溶液 | C、用湿润的淀粉碘化钾试纸可以鉴别NO2和Br2蒸气 | D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A、两种物质的阴离子半径都比阳离子半径小 | B、溶于水,所得溶液都能使无色酚酞变红 | C、与水反应时,水都做氧化剂 | D、与盐酸反应都只生成一种盐 |
下列说法中正确的是( )
| A、用碱石灰除去氯气中的水 | B、碘化银是重要的感光材料,溴化银可用于人工降雨 | C、过氧化钠可用作潜艇里氧气的来源 | D、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
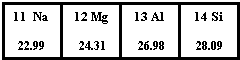 如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )| A、Si元素的名称是硅,其核电荷数为14 | B、Mg原子的结构示意图是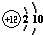 | C、Al的相对原子质量是26.98g | D、它们都属于金属元素 |
下列说法中正确的是( )
| A、O、Na、S元素的原子半径依次增大 | B、KOH、Mg(OH)2、Ba(OH)2的碱性依次增强 | C、H2SO4、H3PO4、HClO4的酸性依次增强 | D、F2、Cl2、Br2、I2的氧化性依次减弱 |