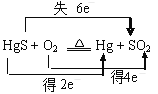
题目内容
【题目】如图所示装置可通过发生“3N2O4+8HNO3=6N2O5+2NO+4H2O”制备N2O5,有关说法中错误的是( )
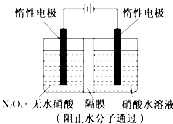
A.阴极的电极反应为:NO3﹣+4H++3e﹣=NO↑+2H2O
B.阳极的电极反应为:N2O4+2 HNO3﹣2e﹣ =2N2O5+2H+
C.当电路中通过6 mol e﹣时整个电解池中参与反应的HNO3为8mol
D.当电路中通过6 mol e﹣时,有8molH+从阳极向阴 极迁移
【答案】D
【解析】
试题分析:在反应3N2O4+8HNO3=6N2O5+2NO+4H2O中,阳极上N2O4发生氧化反应,生成N2O5,每摩N2O4反应转移电子2mol;HNO3在阴极发生还原反应,生成NO,每摩HNO3被还原时转移电子3mol,电解质溶液为酸性环境,可以形成电极反应式;阴极发生还原反应,电极反应式为:NO3-+4H++3e-=NO↑+2H2O,故A正确;阳极发生还原反应,电极反应式为:N2O4+2 HNO3-2e-=2N2O5+2H+,故B正确;从反应方程式可见,每8mol硝酸反应,只有2mol被还原,转移6mol电子,故C正确;依据电荷守恒,当电路中通过6 mol e-时,应有6molH+从阳极向阴极迁移,故D错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目