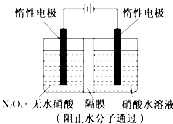
题目内容
【题目】汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。

下列分析错误的是
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为:
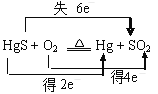
B.辰砂与氧化钙加热反应时,CaSO4为氧化产物
C.洗涤粗汞可用5%的盐酸代替5%的硝酸
D.减压蒸馏的目的是降低汞的沸点,提高分离效率
【答案】C
【解析】
试题分析:A、根据题给反应分析,“灼烧辰砂法”过程硫元素的化合价由—2价升高到+4价,汞元素的化合价由+2价降为0价,氧元素的化合价由0价降为—2价,电子转移的数目为6,故A正确;B、辰砂与氧化钙加热反应时,化合价升高的元素S所在的产物CaSO4为氧化产物,故B正确;C、粗汞中含有的金属铜可以和硝酸之间反应,但是和盐酸之间不反应,所以洗涤粗汞不可用5%的盐酸代替5%的硝酸,故C错误;D、减压蒸馏的目的是降低汞的沸点,提高分离效率,故D正确。

【题目】

(1)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制80 mL与所示消毒液物质的量浓度相同的消毒液,需要称量NaClO固体的质量为 g;所用到的玻璃仪器有玻璃棒、烧杯、量筒和 。
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制2000mL 2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________mol·L-1。
②需用浓硫酸的体积为________mL。
(4)配置一定物质的量浓度的稀硫酸时,下列操作会使所配溶液物质的量浓度偏低的是
A.定容时俯视容量瓶刻度线 |
B.用量筒量取浓硫酸时俯视刻度线 |
C.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液 |
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线。 |
E、加水时超过刻度线,用胶头滴管吸出