题目内容
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究。
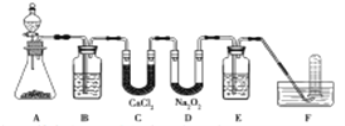
(1)A是实验室制取CO2的装置,其中发生反应的离子方程式是___________________;装置B的作用是____________,装置C的作用是____________,装置E装的试剂是___________。
(2)检验F中气体成分,即能说明过氧化钠可作潜水艇供氧剂,则过氧化钠作潜水艇供氧剂的化学反应方程为___________________________。
(3)设计并完成ag过氧化钠样品(已知所含杂质与酸碱均不反应)的纯度测定:将蒸馏水先加热煮沸,再把蒸馏水分成两份,一份中趁热加入样品溶解,待冷却到室温后再加入另一份水来进行配制。取出配制的溶液20.00mL,加入酚酞数滴后,用浓度为cmol/L的盐酸进行滴定;重复滴定操作2次,计算出所用盐酸的体积平均值为VmL。
①过氧化钠样品的纯度测定步骤中,趁热加入样品溶解,理由是__________________。
②原过氧化钠样品的纯度是________。
【答案】(1)CaCO3+2H+=Ca2++H2O+CO2↑;除去CO2中混有的HCl;干燥CO2;NaOH溶液
(2)2Na2O2+2CO2=2Na2CO3+O2
(3)①沸水能使Na2O2溶解时所生成的H2O2迅速分解,消除其对中和滴定(特别是指示剂)的影响.②19.5cVw /a%(3分)
【解析】
试题分析:(1)A是实验室制取CO2的装置,其中发生反应的离子方程式是CaCO3+2H+=Ca2++H2O+CO2↑;由于盐酸易挥发,生成的二氧化碳中含有氯化氢气体,因此装置B的作用是除去CO2中混有的HCl。装置C中氯化钙的作用是干燥CO2;二氧化碳会影响氧气的收集,则装置E装的试剂是NaOH溶液,原来除去二氧化碳;
(2)二氧化碳与过氧化钠反应生成氧气,反应的方程式为2Na2O2+2CO2=2Na2CO3+O2。
(3)①沸水能使Na2O2溶解时所生成的H2O2迅速分解,消除了双氧水对中和滴定(特别是指示剂)的影响;
②的操作合理,若100mL配制的样品溶液完全用该浓度的盐酸中和,消耗盐酸体积应该为:(VWmL×100mL)/ 20mL=5VWmL,消耗氯化氢的物质的量为:cmol/L×5VW×10-3L=5cVW×10-3mol,则样品中含有氢氧化钠的物质的量为:5cVW×10-3mol,过氧化钠的物质的量为:0.5×5cVW×10-3mol=2.5cVW×10-3mol,样品的纯度为:(78g/mol×2.5cVW×10-3mol)/ag×100%=![]() 。
。