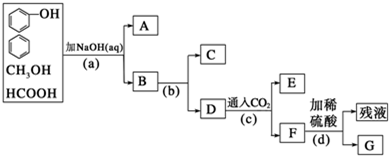
题目内容
2.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验.甲同学向1mol•L-1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热煮沸饱和FeCl3溶液;
丙同学向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热. 试回答下列问题:
(1)其中操作正确的同学是丙;他的操作中涉及到的化学反应方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl
(2)证明有Fe(OH)3胶体生成的实验操作及现象是用激光笔照射,有一条明亮的光路,则有胶体生成
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带正电荷,这种现象称为胶体的电泳.
②向其中滴加稀硫酸至过量,产生的现象是先生成红褐色沉淀,后溶解变为黄色溶液.
(3)提纯此分散系的方法叫渗析,要保证全部的杂质分子和离子完全除去,实验中必须多次更换水或放入流动水中,直至检验不到氯离子.
分析 (1)制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热;
(2)只有胶体具有丁达尔效应,可以验证胶体的产生;胶体的电泳实验证明了胶体胶粒是带电的;
(3)胶粒不能透过半透膜,离子可以透过半透膜,可用渗析的方法分离.
解答 解:(1)甲同学向1mol•L-氯化铁溶液中加入少量的NaOH溶液,会发生复分解反应生成红褐色沉淀,乙同学直接加热饱和FeCl3溶液,三价铁会水解生成红褐色沉淀,制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,原理是:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,
故答案为:丙;FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(2)胶体具有丁达尔效应:当光束通过胶体时,从侧面观察到一条光亮的“通路”,胶体具有电泳性质,电泳实验证明了胶体胶粒带点,胶粒向负极移动,说明Fe(OH)3胶粒带正电,胶体遇电解质发生聚沉,氢氧化铁与硫酸反应生成硫酸铁,故答案为:用激光笔照射,有一条明亮的光路,则有胶体生成;Fe(OH)3胶粒带正电荷;胶体的电泳;先生成红褐色沉淀,后溶解变为黄色溶液;
(3)胶粒不能透过半透膜,离子可以透过半透膜,可用渗析的方法分离,要保证全部的杂质分子和离子完全除去,实验中必须多次更换水或放入流动水中,直至检验不到氯离子,故答案为:渗析;多次更换水或放入流动水中,直至检验不到氯离子.
点评 本题考查制备实验方案的设计,涉及胶体的制备、性质,题目难度不大,易错点为胶体的制备,本题重点把握胶体的制备.

| A. | 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,从分液漏斗下端放出I2的CCl4溶液 | |
| B. | 某元素由化合态转化为游离态,该元素一定被氧化 | |
| C. | 除去CO气体中少量的CO2:通过盛有NaOH溶液的洗气瓶 | |
| D. | 某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中含有SO42- |
| A. | 40% | B. | 35% | C. | 30% | D. | 无法计算 |

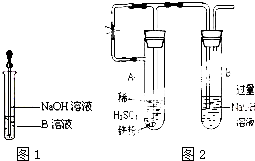 某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.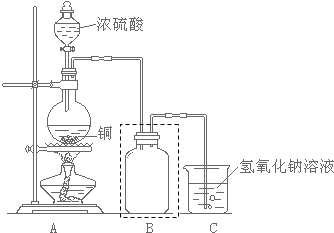
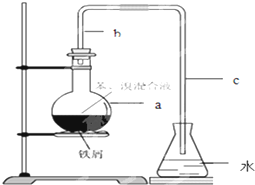 化学课外小组用如图装置制取溴苯.
化学课外小组用如图装置制取溴苯. .
.