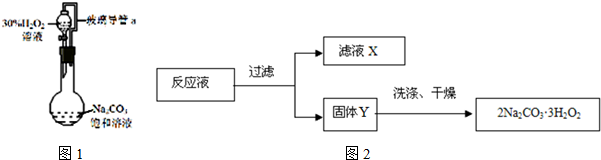
题目内容
17.某研究性学习小组的同学用下图装置研究二氧化硫催化氧化的过程(加热装置已省略),并制取少量三氧化硫晶体,D处盛放V2O5作为催化剂,E处为冰水浴.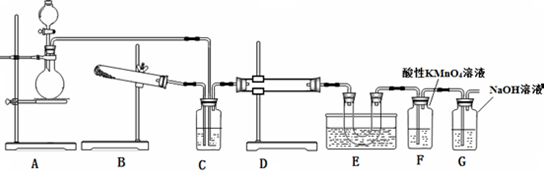
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)检查装置的气密性.
(2)D中发生的化学反应方程式为2SO2+O2$?_{△}^{催化剂}$2SO3.
(3)C装置中盛放的液体药品是浓硫酸;装置C的三个作用是:
①干燥二氧化硫和氧气 ②使二氧化硫和氧气混合均匀③通过观察控制气体比例和气流速度
(4)装置E的作用是使SO3凝结成固体与SO2分离;装置F中溶液逐渐褪色,则该反应的离子方程式是5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+.
(5)若装置按A→B→C→D→E→G→F连接顺序进行实验,且装置G中有40mL 2.5mol•L-1 NaOH溶液,反应后增重4.8g,则装置G中发生总反应的化学方程式是3SO2+4NaOH═Na2SO3+2NaHSO3+H2O.
分析 研究二氧化硫催化氧化的过程(加热装置已省略),并制取少量三氧化硫晶体:A装置:制取二氧化硫,B装置:制取氧气,C装置:干燥二氧化硫和氧气;使二氧化硫和氧气混合均匀;通过观察气泡控制气体比例和流速,D装置:D中发生的是SO2催化氧化的反应,E装置:E的作用是冷却装置,使SO3凝结成固体与SO2分离,F装置:高锰酸钾溶液氧化二氧化硫,G装置:尾气处理.
(1)该实验主要是气体间的反应,所以实验前,必须进行的操作是检查装置的气密性;
(2)D中发生的是SO2催化氧化的反应,即二氧化硫与氧气催化氧化生成三氧化硫;
(3)C装置中盛放的液体药品是浓硫酸,装置C作用:干燥二氧化硫和氧气;使二氧化硫和氧气混合均匀;通过观察气泡控制气体比例和流速;
(4)装置E的作用是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置F中高锰酸钾溶液会和二氧化硫反应逐渐褪色,生成Mn2+,二氧化硫被氧化为硫酸,根据化合价升降总数相等以及电荷守恒书写离子反应方程式;
(5)若装置F中有40mL 2.5mol•L-1NaOH溶液,反应后增重4.8g,吸收的为二氧化硫气体,依据反应方程式及二氧化硫氢氧化钠物质的量进行分析判断生成产物,然后写出反应的化学方程式即可.
解答 解:(1)该实验的目的是研究二氧化硫催化氧化的过程,二氧化硫为气体,参加反应的氧气为气体,主要是气体间的反应,为了保证实验顺利进行,需在实验前必须进行的操作是检查装置的气密性,
故答案为:检查装置的气密性;
(2)D中发生的是SO2与氧气催化氧化生成三氧化硫,化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3,
故答案为;2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)探究二氧化硫催化氧化的过程,需对二氧化硫、氧气进行干燥,C装置中盛放的液体药品是浓硫酸,C装置除了干燥作用,还能使二氧化硫和氧气混合均匀;通过观察气泡控制气体比例和流速,
故答案为:干燥二氧化硫和氧气;使二氧化硫和氧气混合均匀;通过观察控制气体比例和气流速度;
(4)装置E的作用是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置F中高锰酸钾溶液会和二氧化硫反应逐渐褪色,生成Mn2+,二氧化硫被氧化为硫酸,S:+4→+6,↑2,×5,Mn:+7→+2,↓5,×2,所以反应的离子方程式为:5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+,
故答案为:使SO3凝结成固体与SO2分离;5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+;
(5)若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH═Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH═NaHSO3;装置Ⅳ中有40mL 2.5mol•L-1 NaOH溶液中n(NaOH)=0.1mol,n(SO2)=$\frac{4.8g}{64g/mol}$=0.075mol;n(SO2):n(NaOH)=0.075:0.1=3:4,所以生成产物为亚硫酸钠和亚硫酸氢钠,
设生成亚硫酸钠xmol、亚硫酸氢钠ymol,
则:$\left\{\begin{array}{l}{x+y=0.075}\\{2x+y=0.1}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=0.025}\\{y=0.05}\end{array}\right.$,
即n(Na2SO3):n(NaHSO3)=1:2,
所以反应的化学方程式为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O,
故答案为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O.
点评 本题主要考查工业接触法制硫酸的原理,侧重于学生的分析能力和实验能力的考查,为高考常见题型,重点考查制备过程中的注意问题和条件的选择依据,注重了对知识的综合运用和迁移能力考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
产物的有关数据如表所示:
| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀.
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h.
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL 5%碳酸氢钠溶液和30mL水洗涤.
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙.
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g.
请回答下列问题:
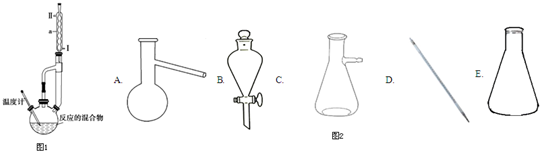
冬青油是一种无色液体,某实验小组利用如图所示的装置制备冬青油.化学反应原理和实验装置如下所示:
(1)本实验中浓硫酸的作用是催化剂、吸水剂.
(2)装置中仪器a的名称是冷凝管,进水口为Ⅱ(填“Ⅰ”或“Ⅱ”).
(3)②中的沸石的作用防止瀑沸,实验过程中发现未加沸石,因采取的操作是B(写序号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)用碳酸氢钠溶液洗涤的目的是将冬青油中的甲醇、水杨酸溶解,便于液体分层;用水洗涤时,产品在下(填“上”或“下”)层.
(5)加入无水氯化钙的目的是除去粗产品中的水分.
(6)粗产品蒸馏过程中,不可能用到的仪器有B.(填正确答案序号)
(7)本次实验中冬青油的产率为89.5%.


 ;
;
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O