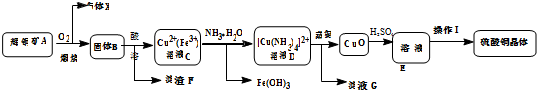
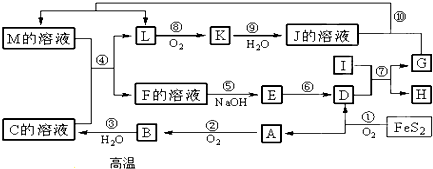
题目内容
4.常温下,下列各组离子,在指定的条件下能大量共存的是( )| A. | 滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH为11的溶液:S2-、SO32-、S2O32-、Na+ | |
| C. | 水电离出来的c (OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 无色透明的溶液:K+、SiO32-、NO3-、Al3+ |
分析 A.滴加甲基橙试剂呈红色的溶液呈酸性;
B.pH=11的溶液呈碱性,离子之间不反应且和氢氧根离子不反应的离子能大量共存;
C.水电离出来的c (OH-)=10-13mol/L的溶液呈酸性或碱性;
D.无色溶液说明不含有色离子,离子之间不反应的能大量共存.
解答 解:A.滴加甲基橙试剂呈红色的溶液呈酸性,酸性条件下Fe2+、NO3-发生氧化还原反应而不能大量共存,故A错误;
B.pH=11的溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故B正确;
C.水电离出来的c (OH-)=10-13mol/L的溶液呈酸性或碱性,HCO3-和氢离子或氢氧根离子都反应,所以不能大量共存,故C错误;
D.无色溶液说明不含有色离子,SiO32-、Al3+发生双水解反应而不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,侧重考查双水解反应、氧化还原反应、复分解反应,明确离子性质及离子共存条件即可解答,易错选项是A.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
5.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为( )
| A. | 504 mL | B. | 168 mL | C. | 224 mL | D. | 336 ml |
19.下列有关比较中,大小顺序排列错误的是( )
| A. | 热稳定性:PH3>H2S>HBr>NH3 | |
| B. | 物质的熔点:石英>食盐>冰>汞 | |
| C. | 结合质子的能力:CO32->CH3COO->SO42- | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
9.把CO2和NO的混合气体VL缓缓通过足量的Na2O2固体,充分反应后,测得剩余气体体积大约只有原来的一半,则混合气体中CO2和NO的体积比不可能是( )
| A. | 2:1 | B. | 3:2 | C. | 3:4 | D. | 5:4 |
16.电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多1,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径是同周期中最小的.下列推断中正确的是( )
| A. | Z的氧化物与水反应可制得相应的含氧酸 | |
| B. | X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 | |
| C. | X、Y、W的原子半径依次减小,对应的离子半径依次增大 | |
| D. | Z的氢化物的热稳定性强于W的氢化物 |
13.经研究发现白蚁信息素有: (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),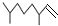 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),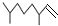 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )| A. | 2,4-二甲基-1-庚烯的分子式为C9H18 | |
| B. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| D. | 1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种 |
14.下列防止金属腐蚀的做法可行的是( )
| A. | 在某些工具的机械转动部位刷油漆以防锈 | |
| B. | 衣架和电线外面包上一层塑料层以防锈 | |
| C. | 在钢材制造的大型船舶上装上一定数量的锌块 | |
| D. | 自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨 |