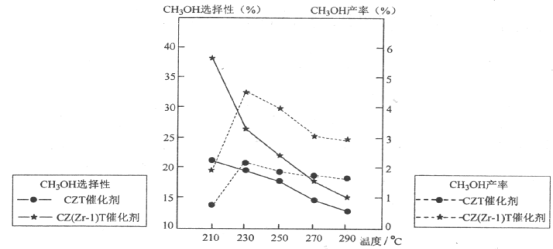
��Ŀ����
����Ŀ�����ⶨ�������Ȼ��Ƶ�С�մ��̬��Ʒ��NaHCO3�����������ɲ����������ַ�����
����һ��
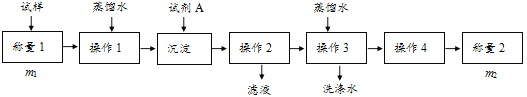
��������
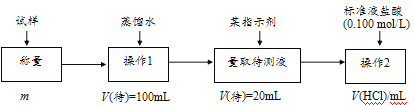
�����ģ���ʹ�û�ѧ�Լ���ʹ��ʵ���ҳ���������
��1������һ�������������Լ�A___����дA�Ļ�ѧʽ���ɽ�HCO3-����ת��Ϊ���������ء�����1��2��3��4�������������ܽ⡢___��ϴ�Ӻ��
��2�����������ڲ���1�����õ��IJ��������У������ձ����������⣬����Ҫ���õ�����___���ڲ���2��Ӧѡ�����ָʾ����
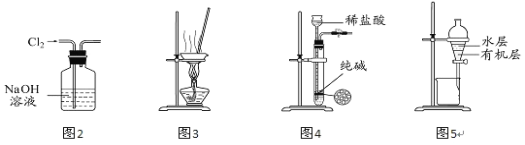
��3���ڷ������м������Ʒ��NaHCO3����������Ϊ___[������ͼ�е�����m��V��HCl����д�йصı���ʽ]��
��4���ڷ������У��������õ�ʵ��װ�ã����˳������������⣬����ⶨ��ʵ��������___��
��5����ϸ�����������е�ʵ��װ�ã����ɴ˲�õ�����������ʵ���������п���ƫ��Ҳ�п���ƫ�ͣ�ƫ�ߵ�ԭ�������___��ƫ�͵�ԭ�������___�������ּ�������
��6�������ĵ�ʵ��ԭ���ǣ�___���û�ѧ����ʽ��ʾ����
���𰸡�Ca��OH��2��Ba��OH��2 ���� 100mL����ƿ ![]() ��100% ��ʯ����ʵ��ǰ������� ��ʯ�ҿ��ܻ������տ����е�ˮ����CO2���� Բ����ƿ�ڻ����沿��CO2���� 2NaHCO3
��100% ��ʯ����ʵ��ǰ������� ��ʯ�ҿ��ܻ������տ����е�ˮ����CO2���� Բ����ƿ�ڻ����沿��CO2���� 2NaHCO3![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
��������
��1����HCO3-��Ӧ�����������Լ���Ca��OH��2�� Ba��OH��2����HCO3-��Ӧ����������Ӧ���еIJ���Ϊ���ˡ�ϴ�ӡ����
��2����̬��Ʒ��ˮ�ܽ��100mL��Һ�����Ի���100mL������ƿ��
��3������������̼�����ư�1��1��Ӧ������������������ʵ�����Ϊ̼�����Ƶ����ʵ���������100mL��ȡ20mL���еζ�������ԭҺ�Ǵ���Һ��5�������ݹ�ϵʽ�������NaHCO3������������
��4���������Ϸ��������ò���������̼������������̼�����Ƶ�������������Ҫ����װ�м�ʯ�ҵĸ������ʵ��ǰ���������
��5����Ϊ��ʯ��ֱ��������Ӵ�������ƫ�ߵ�ԭ���Ǽ�ʯ�һ������տ����еĶ�����̼��ˮʹ����������Ϊװ���л����в����Ķ�����̼������ƫ�͵�ԭ����װ���л��в����Ķ�����̼δ�����գ�
��6������̼�����ƹ������ȷֽⷴӦǰ������������̼�����Ƶ�����������
��1������һ����HCO3-��Ӧ�����������Լ���Ca��OH��2�� Ba��OH��2�������Լ�AΪCa��OH��2�� Ba��OH��2����HCO3-��Ӧ����������Ӧ���еIJ���Ϊ���ˡ�ϴ�ӡ�����ʴ�Ϊ��Ca��OH��2 ��Ba��OH��2�����ˣ�
��2���������й�̬��Ʒ��ˮ�ܽ��100mL��Һ�����Ի���100mL������ƿ���ʴ�Ϊ��100mL����ƿ��
��3������������̼�����ư�1��1��Ӧ������������������ʵ�����Ϊ̼�����Ƶ����ʵ���������100mL��ȡ20mL���еζ�������ԭҺ�Ǵ���Һ��5����������Ʒ��NaHCO3������ΪV��HCl����10-3��0.100��5��84=0.042V��HCl��g����������Ϊ![]() ��100%���ʴ�Ϊ��
��100%���ʴ�Ϊ��![]() ��100%��
��100%��
��4���������Ϸ��������ò���������̼������������̼�����Ƶ�������������Ҫ����װ�м�ʯ�ҵĸ������ʵ��ǰ����������ʴ�Ϊ����ʯ����ʵ��ǰ���������
��5����Ϊ��ʯ��ֱ��������Ӵ�������ƫ�ߵ�ԭ���Ǽ�ʯ�һ������տ����еĶ�����̼��ˮʹ����������Ϊװ���л����в����Ķ�����̼������ƫ�͵�ԭ����װ���л��в����Ķ�����̼δ�����գ��ʴ�Ϊ����ʯ�ҿ��ܻ������տ����е�ˮ����CO2���壻Բ����ƿ�ڻ����沿��CO2���壻
��6������������ѧ�Լ�����ֻ����̼�����Ƶ����ȷֽ⣬���ù��巴Ӧǰ������������̼�����Ƶ�������������ѧ����ʽ��2NaHCO3 ![]() Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3 ![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�����Ŀ����ǹ�ҵ���Ʊ�Na2S2O3�ķ���֮һ����Ӧԭ��Ϊ��2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2���÷�Ӧ��>0��ij�о�С����ʵ��������Ʊ�Na2S2O3��5H2O�������¡�

��1������װ����ͼ��ʾ��

��װ��B�������Ǽ���װ����SO2������Ч�ʣ�B���Լ���________������SO2����Ч�ʵ͵�ʵ��������B����Һ________________��
��Ϊ��ʹSO2������������ȫ���ڲ��ı�A����ҺŨ�ȡ�����������£����˼�ʱ���跴Ӧ���⣬���ɲ�ȡ�ĺ�����ʩ��_______��_______����д��������
��2�����豾ʵ�����õ�Na2CO3������NaCl��NaOH�����ʵ�鷽�����м��顣������ʱCaCO3������Һ��pH=12��, �����Լ���������ϡ���ᡢAgNO3��Һ��CaCl2��Һ��Ca(NO3)2��Һ����̪��Һ������ˮ��pH�ơ��ձ����Թܡ��ιܡ�
��� | ʵ����� | Ԥ������ | ���� |
�� | ȡ������Ʒ���Թ��У�������������ˮ��������ܽ⣬_________�� | �а�ɫ�������� | ��Ʒ��NaCl |
�� | ��ȡ������Ʒ���ձ��У�������������ˮ��������ܽ⣬_________�� | �а�ɫ�������ɣ��ϲ���ҺpH>10.2 | ��Ʒ��NaOH |
��3��Na2S2O3��Һ�Ƕ���ʵ���еij����Լ����ⶨ��Ũ�ȵĹ������£�
��һ����ȷ��ȡag KIO3����Է���������214�����������Һ��
�ڶ������������KI�����H2SO4��Һ���μ�ָʾ����
����������Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��Һ��Һ�����ΪvmL ��c(Na2S2O3��Һ)��_______mol��L-1����ֻ�г���ʽ���������㣩
��֪��IO3-��I-��6H+=3I2+3H2O ��2S2O32-��I2=S4O62-��2I- ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�Na2S2O3��Ũ�ȿ���_____�������Ӱ�족����ƫ�͡���ƫ�ߡ�) ��ԭ����________�������ӷ���ʽ��ʾ����