题目内容
 (1)以H2、O2和强碱溶液设计一个氢氧燃料电池,参与正极反应的物质是
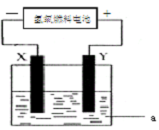
(1)以H2、O2和强碱溶液设计一个氢氧燃料电池,参与正极反应的物质是(2)如图,X和Y是两块电极板,a为电解液.
①若X和Y均为惰性电极,a为CuSO4溶液.则电解反应的总化学方程式为
②若X、Y分别为Fe和Cu,a仍为CuSO4溶液,则Y极反应式为
分析:(1)氢氧燃料碱性电池中,氢气失电子发生氧化反应,则氢气所在电极为负极,氧气所在电极为正极,正极上得电子发生还原反应;
(2)①用惰性电极电解硫酸铜溶液时,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气;根据“析出什么加入什么”的原则知,析出的实质上相当于氧化铜,根据氧化铜和转移电子之间的关系式计算;
②若X是铁,Y是铜,电解质溶液是硫酸铜溶液,则该装置是电镀池,铜作阳极,阳极上铜失电子发生氧化反应.
(2)①用惰性电极电解硫酸铜溶液时,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气;根据“析出什么加入什么”的原则知,析出的实质上相当于氧化铜,根据氧化铜和转移电子之间的关系式计算;
②若X是铁,Y是铜,电解质溶液是硫酸铜溶液,则该装置是电镀池,铜作阳极,阳极上铜失电子发生氧化反应.
解答:解:(1)氢氧燃料碱性电池中,正极上氧气得电子发生还原反应,负极上氢气失电子发生氧化反应和氢氧根离子生成水,电极反应式为H2+2OH--2e-=2H2O,
故答案为:O2;H2+2OH--2e-=2H2O;
(2)①用惰性电极电解硫酸铜溶液时,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气,则电池反应式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,根据原子守恒知,0.3mol CuO中铜的物质的量是0.3mol,根据铜和转移电子之间的关系式得,转移电子的物质的量=0.3mol×(2-0)=0.6mol,
故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;0.6 mol;
②若X是铁,Y是铜,电解质溶液是硫酸铜溶液,则该装置是电镀池,铜作阳极,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+.
故答案为:O2;H2+2OH--2e-=2H2O;
(2)①用惰性电极电解硫酸铜溶液时,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气,则电池反应式为:2CuSO4+2H2O
| ||
故答案为:2CuSO4+2H2O
| ||
②若X是铁,Y是铜,电解质溶液是硫酸铜溶液,则该装置是电镀池,铜作阳极,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+.
点评:本题考查了原电池和电解池原理,明确各个电极上得失电子是解本题关键,难点是电极反应式的书写,注意书写电极反应式时要结合电解质溶液的酸碱性,难度中等.

练习册系列答案
相关题目
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3h):
相应的化学方程式:N2(g)+3H2O(l)?2NH3(g)+
O2(g)△H=+765.2kJ?mol-1
回答下列问题:
(1)该反应在较低温度下能否自发进行? ;
(2)从323K到353K,氨气的生成量减少的原因 ;
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;
(4)工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
.该条件下反应2NH3(g)?N2(g)+3H2(g)的平衡常数为 ;
(5)利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为 ;
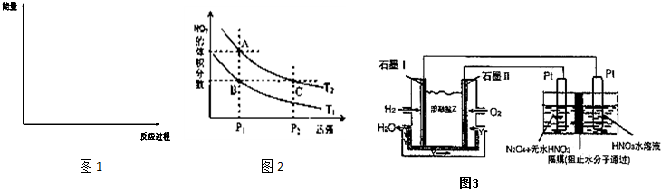
(6)对反应N2O4(g)?2NO2(g),在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是 ;
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
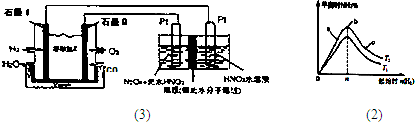
(7)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式 ;在电解池中生成1molN2O5转移电子的物质的量为 .
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
回答下列问题:
(1)该反应在较低温度下能否自发进行?
(2)从323K到353K,氨气的生成量减少的原因
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;

(4)工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
| 4 |
| 7 |
(5)利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为
(6)对反应N2O4(g)?2NO2(g),在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(7)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式
 Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是
Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是
 近年,我国在航天事业上取得了令世界瞩目的成就,神舟飞船多次被长征系列火箭送入太空.
近年,我国在航天事业上取得了令世界瞩目的成就,神舟飞船多次被长征系列火箭送入太空.