题目内容
以下现象与原电池反应无关的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置后表面变暗 |
D
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
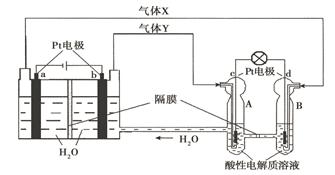
某装置如图所示,该装置工作过程中,下列判断错误的是
| | 甲池 | 乙池 |
| A | Zn极:Zn-2e-= Zn2+ | Cu极:Cu-2e-= Cu2+ |
| B | Cu2+移向C电极 | Cl-移向Fe电极 |
| C | 每消耗1molZn | 生成1mol气体 |
| D | C极的质量增加ag | Cu极的质量减小ag |
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。 欲使溶液恢复到起始状态,可向溶液中加入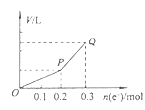
| A.0.1 mol CuO | B.0.1 mol CuCO3 |
| C.0.1 mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
镍氢电池的化学方程式为NiO(OH)+MH Nio+M+H2O(M为储氢合金,电解质
Nio+M+H2O(M为储氢合金,电解质
为KOH),下列说法不正确的是
| A.充电过程中,电池的负极上发生的反应为H2O +M+ e- =MH+OH- |
| B.储氢合金位于电池的负极 |
| C.放电时,OH-离子向电池的负极移动 |
| D.充电过程中,化学能转化为电能储存在电池中 |
高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
Ni(OH)2+M NiOOH+MH,下列叙述正确的是 ( )
NiOOH+MH,下列叙述正确的是 ( )
| A.放电时正极附近溶液的碱性增强 |
| B.放电时负极反应为:M+H2O+e-=MH+OH- |
| C.充电时阳极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- |
| D.放电时每转移1 mol电子,正极有1 mol NiOOH被氧化 |
下列与金属腐蚀有关的说法,正确的是 ( )。
| A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 |
| C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 |
| D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )。
| A.锌作阳极,铁制品作阴极,溶液中含有锌离子 |
| B.铂作阴极,铁制品作阳极,溶液中含有锌离子 |
| C.铁作阳极,铁制品作阴极,溶液中含有亚铁离子 |
| D.锌作阴极,铁制品作阳极,溶液中含有亚铁离子 |
下列关于原电池的叙述中正确的是( )。
| A.正极和负极必须是两种不同的金属 |
| B.电子流入的一极为正极 |
| C.原电池工作时,正极和负极上发生的都是氧化还原反应 |
| D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成 |