题目内容
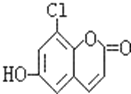
【题目】![]() 时,一定量的
时,一定量的![]() 与盐酸混合所得溶液中,部分含碳微粒的物质的量分数
与盐酸混合所得溶液中,部分含碳微粒的物质的量分数![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是
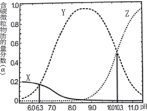
A.曲线X表示的微粒为![]()
B.![]() 时,
时,![]()
C.![]() 时,
时,![]()
D.![]() 时,
时,![]()
【答案】D
【解析】
随着溶液PH的增大,H2CO3浓度逐渐降低,HCO3-浓度逐渐增大,当HCO3-浓度增大到最大值时,PH继续增大时,HCO3-浓度逐渐降低,CO32-浓度逐渐增大。所以X为H2CO3,Y为HCO3-,Z为CO32-。
A.碳酸钠溶液中碳酸根离子水解溶液显碱性,分析图象可知曲线Z为CO32- 微粒的变化曲线,故A错误;
B.pH=6.3时,图象中可知主要为H2CO3和HCO3-,H2CO3和HCO3-以及H2CO3三者的物质的量分数都小于0.2,各成分α(CO32-)+α(HCO3-)+α(H2CO3)<1.0,故B错误;
C.pH=7时c(OH-)=c(H+),此时为H2CO3和HCO3-,c(HCO3-)>c(H2CO3)>c(CO32-),c(HCO3-)>c(H2CO3)>c(CO32-)>c(OH-)=c(H+),故C错误;
D.pH=10.3 时,c(CO32-)=c(HCO3-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(HCO3-)+2c(CO32-)=c(Cl-)+c(OH-)+3c(HCO3-),故D正确;
故答案为D。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是__________。
A.  B.
B. 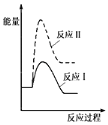
C. 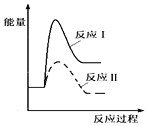 D.
D.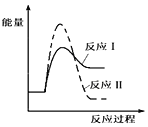
(2)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表(已知2SO2(g)+O2(g) ![]() 2SO3(g)△H=196.6kJ·mol-1) 则:
2SO3(g)△H=196.6kJ·mol-1) 则:
容器 | 甲 | 乙 | 丙 | (填>,=,<) A.2c1_____c3 B.a+b_____196.6 C.2p2____p3 D.α1+α3___1 |
反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO3 | |
SO3的浓度 (mol·L-1) | C1 | C2 | C3 | |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ | |
体系压强 | P1 | P2 | P3 | |
反应物转化率 | α1 | α2 | α3 |
(3)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。
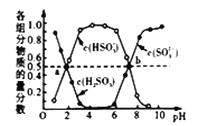
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=_____。
(4)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO ![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图所示:
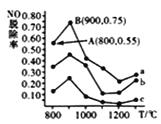
①曲线c对应NH3与NO的物质的量之比是__________。
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为__________mg/(m3·s)。
(5)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/L Na2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO42- (aq)+BaCO3(s) ![]() BaSO4 (s)+CO32-(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO42-)=____mol·L-1(保留小数点后两位).
BaSO4 (s)+CO32-(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO42-)=____mol·L-1(保留小数点后两位).