题目内容
如图装置中,a是250 mL的烧瓶,其中盛有标准状况下的空气(O
(1)将气体b中的Cu粉小心倒入烧瓶中,要使Cu粉发生反应,是否一定需要对反应混合物进行加热(填“是”或“否”) ,发生反应的化学方程式是 ;充分反应后Cu粉有剩余,在反应过程中可观察到的现象是:① ,② ,③ ,④ ;
(2)欲加快铜与硝酸的反应速率,可采用多种不同的措施,若采用化学试剂法,下列试剂中可以使用的是(填代号) ;
A.蒸馏水 B.无水醋酸钠 C.石墨 D.AgNO3(少量)
(3)将烧瓶不断振荡,发现气球逐渐变小,直至被吸入烧瓶内,发生这一现象的原因是(用化学方程式表示) 。
(4)打开弹簧夹将CO2推入干燥管内继续振荡,使气体与气体、气体与液体间充分接触,可使剩余铜粉完全溶解,上述整个过程用一个总化学方程式表示则为:
,在此过程中,至少需要CO2 mL。(标准状况)
解析:
| (1)否;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
①液面有无色气泡冒出;②瓶中无色气体逐渐变成红棕色;③气球膨胀;④溶液变蓝色; (2)C D (3)4NO+3O2+2H2O=4HNO3或4NO2+O2+2H2O=4HNO3或2NO+O2=2NO2 3NO2+H2O=2HNO3+NO (4)2Cu+O2+4HNO3=2Cu(NO3)2+2H2O; 34.4
|
提示:
| 将b中的铜粉倒入烧瓶中,铜与烧瓶中的稀硝酸发生反应,生成硝酸铜蓝色溶液和无色的NO气体,从溶液中逸出,由于烧瓶中有空气,空气中的氧气与生成的NO继续反应变成红棕色的NO2,产生的气体使气球膨胀。
欲加快铜跟硝酸的反应速率,可加入石墨或硝酸银溶液与铜形成原电池。将烧瓶不断振荡,烧瓶中的NO和NO2与空气中的O2及溶液中的水反应生成硝酸4NO+3O2+2H2O=4HNO3或4NO2+O2+2H2O=4HNO3,使烧瓶中气体压强减小,气球不断变小,直至吸入烧瓶中。整个过程发生两个反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O和4NO+3O2+2H2O=4HNO3,将两个反应相加,即得到总反应方程式为: 2Cu+O2+4HNO3=2Cu(NO3)2+2H2O。根据此反应方程式判断出铜过量,若要使铜完全反应共需氧气67.2 mL。现烧瓶中空气里含有氧气250 mL×1/5=50 mL,还需要氧气67.2 mL -50 mL=17.2 mL。 根据氧气与二氧化硫的关系,计算可得: O2 ~ 2CO2 22400 mL 2×22400 mL 17.2 mL x
x=34.4 mL 至少需要二氧化碳34.4 mL。
|

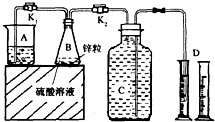 某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:
某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:| 实验序号 | 硫酸浓度 | 饱和硫酸铜溶液体积/mL | 反应达到平稳的时间/min | 第1分钟收集氢气体积/mL | 第2分钟收集氢气体积/mL | 第3分钟收集氢气体积/mL | … |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | … |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | … |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | … |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | … |
(1)关闭K2、打开K1,观察到
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有
| 2 |
| 5 |
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为
A. 20 B.30 C.27 D. 40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验
(6)从实验后的废液中回收皓矾(ZnSO4?7H2O)所需的实验操作步骤是
(7)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.