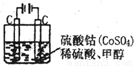
题目内容
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.
反应I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
反应II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
(1)CH3OH (g)和H2(g)反应生成CH4(g)与H2O(g)的热化学方程式为
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为
②100℃时反应I的平衡常数为
③可用来判断该反应达到平衡状态的标志有
A.CO的含量保持不变
B.容器中CH4浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.3V正(CH4)=V逆(H2)
(3)按照反应II来生成甲醇,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1>T2>T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数:K(a)>K(c); K(b)=K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(4)工业上利用甲醇制备氢气的常用方法之一为:甲醇蒸汽重整法.该法中的一个主要反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是
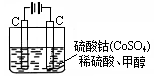
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图3装置模拟上述过程:
①写出阳极电极反应式
②写出除去甲醇的离子方程式
③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池负极的电极反应式为:

反应I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
反应II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
(1)CH3OH (g)和H2(g)反应生成CH4(g)与H2O(g)的热化学方程式为
CH3OH (g)+H2(g)=CH4(g)+H2O(g)△H=-77.0 kJ?mol-1
CH3OH (g)+H2(g)=CH4(g)+H2O(g)△H=-77.0 kJ?mol-1
.(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为
0.03 mol?L-1?min-1
0.03 mol?L-1?min-1
.②100℃时反应I的平衡常数为
2.25×10-2
2.25×10-2
.③可用来判断该反应达到平衡状态的标志有
A D
A D
.(填字母)A.CO的含量保持不变
B.容器中CH4浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.3V正(CH4)=V逆(H2)
(3)按照反应II来生成甲醇,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
C
C
A.温度:T1>T2>T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数:K(a)>K(c); K(b)=K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(4)工业上利用甲醇制备氢气的常用方法之一为:甲醇蒸汽重整法.该法中的一个主要反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是
该反应是一个熵增的反应
该反应是一个熵增的反应
.(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图3装置模拟上述过程:
①写出阳极电极反应式
Co2+-e-=Co3+
Co2+-e-=Co3+
.②写出除去甲醇的离子方程式
6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+
6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+
.③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池负极的电极反应式为:
CH3OH-6e-+8OH-═CO32-+6H2O
CH3OH-6e-+8OH-═CO32-+6H2O
.分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)①分析图象100℃时达到平衡,甲烷转化率为50%;结合化学平衡三段式列式计算得到;
②计算平衡状态物质浓度结合平衡常数概念列式计算;
③平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
(3)A.该反应为放热反应,温度越低,CO的转化率越大;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快;b、d两点压强相同,温度越高,反应速率越大;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,K值增大.平衡常数只与温度有关,b、d两点温度相同,平衡常数相同;
D.CO转化率的越大,n总越小,由M=
判断;
(4)CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的判断依据是△H-T△S<0;
(5))①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③甲醇-空气-KOH溶液的燃料电池,则电池负极是甲醇失电子发生氧化反应在碱溶液中生成碳酸钾;
(2)①分析图象100℃时达到平衡,甲烷转化率为50%;结合化学平衡三段式列式计算得到;
②计算平衡状态物质浓度结合平衡常数概念列式计算;
③平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
(3)A.该反应为放热反应,温度越低,CO的转化率越大;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快;b、d两点压强相同,温度越高,反应速率越大;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,K值增大.平衡常数只与温度有关,b、d两点温度相同,平衡常数相同;
D.CO转化率的越大,n总越小,由M=
| m |
| n |
(4)CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的判断依据是△H-T△S<0;
(5))①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③甲醇-空气-KOH溶液的燃料电池,则电池负极是甲醇失电子发生氧化反应在碱溶液中生成碳酸钾;
解答:解:(1)I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律Ⅰ+Ⅱ得到CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1
所以CH3OH (g)和H2(g)反应生成CH4(g)与H2O(g)的热化学方程式为:CH3OH (g)+H2(g)=CH4(g)+H2O(g)△H=-77.0 kJ?mol-1
故答案为:CH3OH (g)+H2(g)=CH4(g)+H2O(g)△H=-77.0 kJ?mol-1
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I:图象分析可知100°C甲烷转化率为50%,依据化学平衡三段式列式
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol) 1.0 2.0 0 0
变化量(mol) 1.0×50% 0.5 0.5 1.5
平衡量(mol) 0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=
=0.03 mol?L-1?min-1
故答案为:0.03 mol?L-1?min-1
②100℃时反应I的平衡浓度为c(CH4)=0.05mol/L,c(H2O)=0.15mol/L,c(CO)=0.05mol/L,c(H2)=0.15mol/L,
平衡常数K=
=
=2.25×10-2
故答案为:2.25×10-2
③CH4 (g)+H2O (g)=CO (g)+3H2 (g)
A.CO的含量保持不变,说明反应达到平衡,故A正确;
B.容器中CH4浓度与CO浓度相等,与消耗量和起始量有关反应不一定达到平衡,故B错误;
C.混合气体质量不变,体积不变,反应过程中密度不变,容器中混合气体的密度保持不变不能说明反应达到平衡,故C错误;
D.反应速率之比等于化学方程式系数之比是正反应速率之比,3V正(CH4)=V正(H2),若3V正(CH4)=V逆(H2)说明V正(H2)=V逆(H2)说明反应达到平衡,故D正确;
故答案为:A D;
(3)A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A错误;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快,故υ(a)<υ(c).b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故B错误;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故C正确;
D.CO转化率的越大,n总越小,由M=
可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D错误;
故选C.
(4)甲醇蒸汽重整法.该法中的一个主要反应为CH3OH(g)?CO(g)+2H2(g),反应△H>0,反应自发进行需要满足△H-T△S<0,所以反应自发进行是因为该反应是熵增大的反应;
故答案为:该反应是一个熵增的反应,△S>0;
(5))①、通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②、以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.;
③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,甲醇在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,则电池负极的电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O;
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律Ⅰ+Ⅱ得到CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1
所以CH3OH (g)和H2(g)反应生成CH4(g)与H2O(g)的热化学方程式为:CH3OH (g)+H2(g)=CH4(g)+H2O(g)△H=-77.0 kJ?mol-1
故答案为:CH3OH (g)+H2(g)=CH4(g)+H2O(g)△H=-77.0 kJ?mol-1
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I:图象分析可知100°C甲烷转化率为50%,依据化学平衡三段式列式
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol) 1.0 2.0 0 0
变化量(mol) 1.0×50% 0.5 0.5 1.5
平衡量(mol) 0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=
| ||
| 5min |
故答案为:0.03 mol?L-1?min-1
②100℃时反应I的平衡浓度为c(CH4)=0.05mol/L,c(H2O)=0.15mol/L,c(CO)=0.05mol/L,c(H2)=0.15mol/L,
平衡常数K=
| c(CO)c3(H2) |
| c(CH4)c(H2O) |
| 0.05×0.153 |
| 0.05×0.15 |
故答案为:2.25×10-2
③CH4 (g)+H2O (g)=CO (g)+3H2 (g)
A.CO的含量保持不变,说明反应达到平衡,故A正确;
B.容器中CH4浓度与CO浓度相等,与消耗量和起始量有关反应不一定达到平衡,故B错误;
C.混合气体质量不变,体积不变,反应过程中密度不变,容器中混合气体的密度保持不变不能说明反应达到平衡,故C错误;
D.反应速率之比等于化学方程式系数之比是正反应速率之比,3V正(CH4)=V正(H2),若3V正(CH4)=V逆(H2)说明V正(H2)=V逆(H2)说明反应达到平衡,故D正确;
故答案为:A D;
(3)A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A错误;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快,故υ(a)<υ(c).b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故B错误;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故C正确;
D.CO转化率的越大,n总越小,由M=
| m |
| n |
故选C.
(4)甲醇蒸汽重整法.该法中的一个主要反应为CH3OH(g)?CO(g)+2H2(g),反应△H>0,反应自发进行需要满足△H-T△S<0,所以反应自发进行是因为该反应是熵增大的反应;
故答案为:该反应是一个熵增的反应,△S>0;
(5))①、通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②、以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.;
③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,甲醇在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,则电池负极的电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O;
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;
点评:本题考查热化学方程式和盖斯定律计算应用,温度、压强、转化率等之间的关系和外界条件对反应速率及平衡的影响,平衡标志判断,原电池原理和电极反应书写,掌握基础是解本题的关键,题目难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
 (1)甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
(1)甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.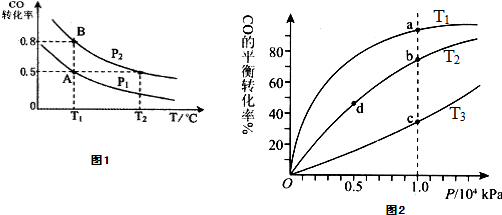
 CO(g)+3H2(g)
△H=+206.0kJ•molˉ1
CO(g)+3H2(g)
△H=+206.0kJ•molˉ1