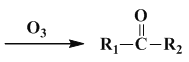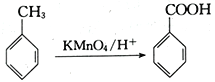题目内容
【题目】某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸溶液在室温下进行反应。实验中所用的草酸为稀溶液,可视为强酸。
(1)将高锰酸钾氧化草酸的离子方程式补充完整。
2MnO4- +_______C2O42- +_____ _____=2Mn2+ +______CO2↑ +_______H2O
(2)该小组进行了实验I,数据如下。
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率______。但分析实验数据,得到的结论是______。
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如下。
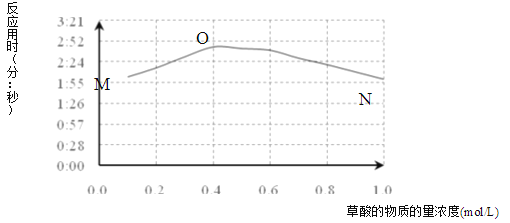
①用文字描述曲线图表达的信息______。
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是______。
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II)。(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物。 |
c | 草酸稳定性较差,加热至185℃可分解。 |
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如下。
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是______。
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因______。为验证该推测还需要补充实验,请对实验方案进行理论设计______。
【答案】5 16 H+ 10 8 增大 在当前实验条件下,增大草酸浓度,反应速率减小 当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加 ab 探究其他离子浓度不变,溶液中H+浓度对反应速率的影响 当草酸浓度较小时,C2O42- 起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大。 为验证C2O42-对反应速率的影响,保持高锰酸钾与硫酸溶液浓度不变,增加草酸钠的浓度,记录反应速率;若随着草酸钠浓度增加,反应速率降;证明C2O42-浓度越大,反应速率越小。(实验方案包括:目的,操作,现象,结论)
【解析】
(1)根据元素守恒知,生成物中生成水,根据转移电子守恒、原子守恒配平方程式;
(2)一般来说,其他条件相同时,增大反应物浓度,反应速率增大,但表格数据草酸浓度大时速率小;
(3)①图象描述的是当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加,据此进行分析;
②据MO变化趋势,得出反应速率随着草酸浓度增加而减小,可能原因是KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II),以及草酸根易与不同价态锰离子形成较稳定的配位化合物,据此进行分析;
(4)该实验中的变值为H+浓度;
(5)当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大。
为验证C2O42-对反应速率的影响,保持高锰酸钾与硫酸溶液浓度不变,增加草酸钠的浓度。
(1)酸性条件下高锰酸根离子和草酸根离子发生氧化还原反应,根据元素守恒知,生成物中生成水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,转移电子数为10,根据转移电子守恒、原子守恒配平方程式得2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,故答案为:5;16H+;10;8;
(2)在当前实验条件下,当高锰酸钾一定时,增大草酸浓度,反应时间延长,故得到的结论是在当前实验条件下,增大草酸浓度,反应速率减小,故答案为:在当前实验条件下,增大草酸浓度,反应速率减小;
(3)①当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加,故答案为:当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加;
②MO变化趋势,得出反应速率随着草酸浓度增加而减小,可能原因是KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II),以及草酸根易与不同价态锰离子形成较稳定的配位化合物,故答案为:ab;
(4)该小组进行实验III中控制的变量是氢离子浓度,加入硫酸钠固体是为了保证硫酸根离子浓度一致,目的是探究其他离子浓度不变,溶液中H+浓度对反应速率的影响,故答案为:探究其他离子浓度不变,溶液中H+浓度对反应速率的影响;
(5)综合实验I、II、III,可推测出造成曲线MN变化趋势的原因是:当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大;
为验证C2O42-对反应速率的影响,应保持高锰酸钾与硫酸溶液浓度不变,增加草酸钠的浓度,记录反应速率;若随着草酸钠浓度增加,反应速率降低;证明C2O42-浓度越大,反应速率越小;
故答案为:当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大;
为验证C2O42-对反应速率的影响,保持高锰酸钾与硫酸溶液浓度不变,增加草酸钠的浓度,记录反应速率;若随着草酸钠浓度增加,反应速率降低;证明C2O42-浓度越大,反应速率越小(实验方案包括:目的,操作,现象,结论)。

【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25